原理
肉与肉制品中的脂类经皂化后,胆固醇作为不皂化物被提取出来,用气相色谱法测定,外标法定量。
试剂如无特别说明,所用试剂均为分析纯。
(1)水:符合GB/T 6682-2008规定的二级水。
(2)乙醚。
(3)三氯甲烷。
(4)无水乙醇。
(5)无水硫酸钠。
(6)氢氧化钾溶液(1 mol/L):称取5.6g氢氧化钾,溶于水中,用水稀释至100mL。
(7)胆固醇标准品:纯度≥95%。
(8)(1m胆固醇标准贮备液g/mL):称取胆固醇标准品0.1000g置于100mL容量瓶中,用三氯甲烷溶解并定容。
(9)胆固醇标准工作液:临用时将胆固醇标准贮备液用无水乙醇稀释至所需浓度。
仪器和设备实验室常规仪器及下列仪器。
(1)机械设备:用于试样的均质化,包括高速旋转的切割机,或多孔板的孔径不超过4mm的绞肉机。
(2)气相色谱仪:配毛细管柱和FID检测器。
(3)电子天平:可准确称重至1mg。
取样实验室所收到的样品应具有代表性且在运输和储藏过程中无受损或发生变化。
取样方法参见GB∕T 9695.19。
取有代表性的样品200 g。
试样制备使用适当的机械设备将试样均质。注意避免试样的温度超过25℃。若使用绞肉机,试样至少通过该设备两次。
将试样装入密封的容器里,防止变质和成分变化。试样应在均质化后24 h内尽快分析。
分析步骤皂化称取0.2-1.0g(准确至0.001g)试样,置于50mL具塞试管中,加入1mol/L氢氧化钾溶液10mL,无水乙醇10mL,混匀,装上冷凝管,在85~95℃水浴上缓缓皂化1h,至试样溶液清澈,皂化后用流水冷却。
提取将皂化后的试样溶液移入50mL分液漏斗中,加10mL乙醚于分液漏斗中,轻轻振摇,静置分层,将水层放入上述具塞试管中。加10mL乙醚于具塞试管,轻轻振摇,静置分层,将乙醚移入上述分液漏斗内。再用10mL乙醚于具塞试管,重复提取一次,将乙醚移入上述分液漏斗内。
用15mL水分三次洗涤分液漏斗中的溶液。分层后弃去水层,用无水硫酸钠10g干燥乙醚,将乙醚层移入另一具塞试管中,通氮气吹干后,加入1.00mL无水乙醇,混匀。
气相色谱参考条件色谱柱:DB-5弹性石英毛细管柱(30m×0.32mm×0.25μm),或相当者;
载气:高纯氦,纯度≥99.99%;恒流2.4mL/min;
柱温(程序升温):初始温度为200℃,保持1min,以30℃/min升至280℃,保持10min;
进样口温度:280℃;
检测器温度:290℃;
进样量:1uL;
进样方式:不分流进样,进样1min后开阀;
空气流速:350mL/min;
氢气流速:30mL/min。
测定根据试样溶液中胆固醇的含量情况,选定峰面积相近的标准工作液。标准工作液和试样溶液中胆固醇的响应值均应在仪器检测线性范围内。标准工作液和试样溶液等体积间隔进样测定。根据保留时间定性,外标法定量。标准色谱图见图1.
平行试验按“皂化-测定”,对同一试样进行平行试验测定。
空白实验除不加入试样外,均按“皂化-测定”进行测定。
计算按下式计算试样中胆固醇的含量。
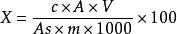 式中:
式中:
X:样品中胆固醇含量,mg/100g;
c:标准工作液中胆固醇的浓度ug/mL;
A:试样溶液中胆固醇的峰面积;
V:试样溶液最终定容的体积,mL;
As:标准工作液中胆固醇的峰面积;
M:脂肪质量,g。
计算结果应扣除空白,结果保留至小数点后一位。
精密度同一分析者在同一实验室采用相同的方法和相同的仪器,在短时间间隔内对同一样品独立测定两次,两次测试结果的绝对差值不得超过10%。1




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国