化学反应的自发性方向(简称为“反应方向”),即在一定条件下,无需借助于外力,反应自动进行的方向。自然界发生的过程都有一定的方向性。例如,水总是自动从高处向低处流,而不会自动进行反方向的流动。又如,当两个温度不同的物体互相接触时,热会自动地从温度高的物体传向温度低的物体,直到两个物体的温度相等为止。就化学变化来看,如果把锌片置于稀硫酸中,锌片会自动溶解并有氢气生成。这些不需要外力作用,便可自发进行的过程称为自发过程(化学过程称为自发反应)1
定义反应方向(reaction direction)是指反应物和生成物均处于标准态时反应进行的方向。2
影响因素焓变化学反应中所吸收或放出的能量有多种形式:热能、光能、声能和电能等。其中所吸收或放出的热量称为反应热(或热效应)。众所周知,反应热不仅与反应物的组成、结构、和性质有关,而且与其状态和用量,以及反应条件(如温度和压力等)有关,热力学上将反应前后温度和压力都不变的反应称为恒温恒压反应。树如,人体内进行的一系列反应,基本上是恒温恒压反应。恒压反应的反应热在数值上等于反应焓变。
对于反应焓变,可作如下理解:反应的吸热或放热表明,反应物和产物各自有不同的“焓”(H),当反应物的焓比产物的焓高(多)时,由反应物变成产物,就要释放出那多余的部分。则反应焓变(△H)为:
△H=H终态—H始态=H产物—H反应物
若H产物0,即为吸热反应
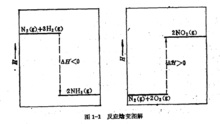
例如,下列两个反应,若进行恒温恒压反应(T=298.15 K,p=101. 325kPa),各自的焓变为(g表示气态)。
N2(g)+8H2(g)→2NH3(g)
△H=[2×H(1molNH3,g)]―[1×H(1molN2,g)+3×H(1molH2,g)]=-92.38kj/mol
N2(g)+2O2(g)→2NO2(g)
△H=[2×H(1molNO2,g)]―[1×H(1molN2,g)+2×H(1molO2,g)]=+67.70kj/mol3
许多化学反应都是向着能量降低的方向进行。而放热是系统能量降低的一种方式,即放热有利于反应的自发进行。所以起初有人提出用焓变做为判断反应方向的依据,即△HS液>S固
b.对同一物质的同一聚集状态而言,温度升高,粒子热运动增加,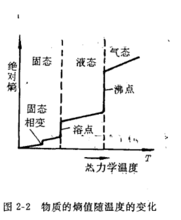
体系的混乱度增大,熵值也将增大。如图2-2所示,即S高温>S低温
c.压力降低时,气体体积增大,粒子在较太的空间运动,
其混乱度必增大,所以低压气体的熵值要比高压气体的大,即
S低气压>S高气压
d·不同物质的熵值不同,与其分子的组成和结构有关。一般而言,
分子越大,结构越复杂,其运动情况也越复杂,混乱度就越大,
熵值也越大。4
吉布斯能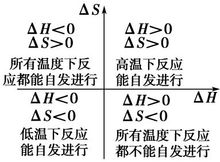 虽然熵增有利于反应的自发进行,但是与反应焓变一样,不能仅用熵变作为反应自发性的判据。例如SO2(g)氧化为SO3(g)的反应在298.15K、标准态下是一个自发反应。但其△rSm
虽然熵增有利于反应的自发进行,但是与反应焓变一样,不能仅用熵变作为反应自发性的判据。例如SO2(g)氧化为SO3(g)的反应在298.15K、标准态下是一个自发反应。但其△rSm




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国