自从1962年巴特列第一次制得含有化学键的稀有气体化合物氟铂酸氙后,各种各样的稀有气体化合物被相继制得,在人类的生产生活中发挥着重要作用。
2017年,中国学者成功制得氦化合物Na2He,自此元素周期表(除半衰期极短的人工合成元素)的最后一个元素也被攻破,完成了这一跨世纪的普世壮举。历史将铭记他们!
介绍稀有气体化合物指含有稀有气体元素的化合物。由于稀有气体元素原子外层为闭壳 结构,化学性质不活泼,因此它们化合物的制备颇费了一些周折。
结构,化学性质不活泼,因此它们化合物的制备颇费了一些周折。
广义上看,稀有气体化合物可以包括稀有气体元素形成的众多包合物和水合物,但现在一般认为1962年得的六氟合铂酸氙是最早制得的稀有气体化合物,因为它的成功合成不仅意味着稀有气体元素有可能形成化合物,而且极大推动了对稀有气体化合物的系统研究。氙的众多简单化合物也是在此不久之后发现。
制备历史稀有气体是第0族的元素,共包括氦、氖、氩、氪、氙和氡、以及最新合成的Oganesson共七个。所有的稀有气体元素外层s和p轨道都填充满了电子,氦有2个外层电子,其它的都为8个。它们的电离能很高,电子亲合能几乎为零,生成化合物的倾向很小。因此直到20世纪,化学家都认为稀有气体化合物不存在,并将这些元素称为“惰性气体”。
然而,莱纳斯·鲍林在1933年时预测,原子序数较大的稀有气体元素有可能与氟和氧生成化合物。他预言了六氟化氪和六氟化氙的存在,提出八氟化氙可能是个不稳定的化合物,以及氙酸会以高氙酸盐的形式成盐。
现在看来,这些预测相当准确,只是八氟化氙这个化合物不仅在热力学上不稳定,而且在动力学上也不稳定。2006年时仍未制得。
相比而言,原子序数较大的稀有气体元素具有更多的电子层,因此内层电子对最外层电子的屏蔽效应致使其电离能减小,可能小到能与电负性强的元素(氟和氧)形成稳定化合物的地步。
在1962年以前,唯一可以分离出来的稀有气体化合物都是包合物,包括水合包合物。其它则是只有在光谱中才可观测到的配位化合物。
化合物氦化合物理论上一些氦化合物在低温高压下能稳定存在,可喜的是,最近一批可敬的中国学者将理论化为现实,氦钠化合物横空出世。
如果你还记得高中化学,那么可能知道氦的奇异特性。作为惰性气体,它是元素周期表中最不容易发生化学反应的元素。拜其“外壳”所赐,一般人们认为氦无法和其他原子发生作用从而创建稳定的化合物。
在极端压力环境下,其他稀有气体已经显示出形成化合物的能力。而氦至今仍是独一无二地稳定。现在,这铁一样的规律已经被来自南开大学的王慧田、周向锋团队及其合作者打破。他们创造出了稳定的氦钠化合物,而这已经撼动了现代化学的基本认知。该研究日前刚刚发表在《Nature Chemistry》。
我们知道,氦是宇宙中含量第二多的元素,是六种惰性气体元素之一,很难与其他元素发生作用。然而,在极端条件下,惰性气体又可以分为两类:其中氪、氙、氡相对活跃,而氩、氖、氦则非常冷漠。
此前,研究人员已经找到其他元素与氦进行配对的方法。但一直以来,都没有形成什么能够稳定存在的物质。最常见的例子就是氦与其他元素的范德华力,无需共价键或者离子键就可以存在。在极低的温度下,氦确实可以形成范德华力,但极其微弱,无法长久保持。
氦这种坚固的稳定力源于其闭壳层电子组态:其外壳层是完满的状态,没有空间和其他原子通过共用电子进行结合。不过这是地球表面环境中的情况。
作为宇宙中第二丰富的元素,氦在恒星和巨型气体行星的构成中起着重要作用。在外太空或者地球深处的极端条件下,它可能遵循着不同寻常的规律。如今,研究人员刚刚验证这种奇异的现象。
犹他州立大学的文章共同作者Alex Boldyrev说:“极高的压力,比如在地球的核心或者其他巨型星体中,能够完全改变氦的化学特性。”
研究人员通过“晶体结构预测”模型进行演算发现,在极度的压力之下,一种稳定的氦钠化合物能够形成。然后他们在金刚石压腔实验中真的创造出了前所未见的化合物:Na2He。实验可以为氦和钠原子提供相当于110万倍地球大气压的条件。
这一结果太出人意料,因此发表的时候遇到了巨大的困难,研究人员花了两年多的时间去说服审稿人和编辑。
基于这些结果,研究团队预测,如果压力达到他们实验水平的一千万倍,那么钠将可以很容易地和氦气反应生成稳定的Na2He。更为奇妙的是,这种化合物的构成并不需要任何化学键。
南开大学王慧田教授是本次研究的共同通讯作者,据他介绍:“所发现的化合物非常奇特:氦原子通常不会形成任何化学键,而新物质的存在从根本上改变了钠原子间的化学相互作用,迫使电子集中在该结构的立方空间内,同时具有绝缘能力。”
Na2He的晶体结构,由钠原子(紫色)和氦原子(绿色)交替,共用电子(红色)存在于其间的区域。
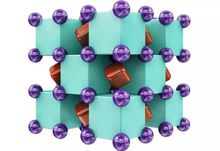
“这并不是真的化学键,”Popov说,“但是氦能够使这一结构稳定存在。如果你把氦原子挪走,该结构将无法保持稳定。”
下面是该化合物的其他表现形式,左图中粉色为钠,白色为氦;右图中钠和氦成立方体状,红色的点则是电子。
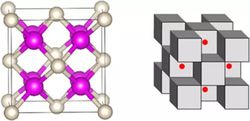
亚晶格分析表明,He的占位导致电子被局域到了原子缝隙中并在Na原子核的引力下形成多中心键,从而整个体系变成了电子盐体系。该过程中,孤立电子,Na的内层电子与He的内层1s电子和外层的2s,2p轨道产生强烈的交叠。受泡利不相容原理的影响,He的1s电子密度和外层电子轨道的分布被迫发生变化导致在Na2He形成过程中He得到了0.15个电子。该工作证实了高压下He会具有弱的化学活性能够与在高压下还原性显著增强的Na形成化合物。
虽然最近关于金属氢的突破研究遇到很大的质疑,但这篇文章的数据要扎实很多。来自伦敦帝国学院的物理学家Henry Rzepa在把这项研究和金属氢的发现对比时表示:“这是更为可靠的科学,氦化合物是一项重大突破。”
这一研究涉及中、美、俄、意、德五国学者。参与的中国研究单位还有北京高压科学研究中心、西北工业大学、中科院固态物理研究所、和南京大学。特别值得一提的是,这一研究开始于南开大学研究生Xiao Dong在美国交换访问期间,根据作者贡献介绍,Xiao Dong设计了研究工作、并展开了相关计算。Xiao Dong目前已经在上海高压科学研究中心工作。1
氖化合物(来自英文维基,其中Van der Waals Molecule不知如何翻译,暂译为范德华力分子,怀疑就是所谓包合物。)
低温高压下,氖可以与很多物质形成“范德华力分子”,例如NeAuF和NeBeS,原子被隔离在惰性气体母体中。NeBeCO3固体可以在氖气氛围中利用红外光谱法检测到。它是由铍气体、氧气和一氧化碳制得的。
与金属形成的“范德华力分子”包括Ne-Li。
更多相似的的“范德华力分子”包括Ne-CF4和Ne-CCl4、Ne2-Cl2、 Ne3-Cl2、Nex-I2(x=1-4)、NexHey-I2(x=1-5,y=1-4)。
与有机分子,包括苯胺,二甲醚,1,1-二氟乙烯、嘧啶、氯苯、环戊酮、环丁腈和环戊二烯等也可形成所谓“范德华力分子”。
氖还可以作为一种配体,对过渡金属原子形成非常薄弱的键,例如Cr(CO)5Ne、Mo(CO)5Ne和W(CO)5Ne。
氩化合物氩已知唯一的化合物为氟氩化氢,由马库·拉萨能领导的芬兰化学家团队发现。
他们将氩气和氟化氢在碘化铯表面冷冻至-265°C,使氩气凝华,然后再用大量的紫外线照射氩(s)和氟化氢的混合物,使之发生反应。经过红外光谱分析后,他们发现氩原子已经和氟原子、氢原子产生化学键,但该化学键非常的弱,只要温度高于-256°C它就会再分解为氩和氟化氢。
氪化合物氪与氟反应可得二氟化氪。有报道称二氟化氪与水在-30℃时反应得到2-3%的“氪酸”KrO3·xH2O,该溶液有氧化性,能将碘离子氧化为碘单质,与氢氧化钡溶液反应得到产率7%的白色晶体“氪酸钡”。这些报道可信度不高,后来也未能重现。在含放射性同位素二氧化硒衰变产物中用光谱检测到Kr-O键的存在,还没有方法合成氧化氪。
氙化合物氙在稀有气体元素中是化合物最多的。
1962年,巴特列在研究无机氟化物时,发现强氧化性的六氟化铂可将O2氧化为O2+。由于O2到O2+的电离能(1165kJ/mol)与Xe到Xe+的电离能相差不大(1170kJ/mol),因此他尝试用PtF6氧化Xe。结果反应得到了橙黄色的固体。巴特利特认为它是六氟合铂酸氙(Xe[PtF6])。 这是第一个制得的稀有气体化合物。后期的实验证明该化合物化学式并非如此简单,包括XeFPtF6和XeFPt2F11。
在成功合成六氟合铂酸氙后,化学家又尝试用类似的六氟化钌来氧化氙。结果发现除了生成Xe(RuF6)x外,还存在有氙和氟气直接生成二元氙氟化物的副反应。因此克拉森(Howard Claassen)通过让氙和氟在高温下反应,成功合成了四氟化氙。
已经制得的、较重要的氙化合物包括:
氙氟化物——XeF2、XeF4、XeF6
氙的氟氧化物——XeOF2、XeOF4、XeO2F2、XeO3F2、XeO2F4
氙氧化物——XeO3、XeO4
二氟化氙可由Xe和F2混合气暴露在阳光下制得。但有趣的是,1960年代之前的半个世纪中,却没有人发现仅仅混合这两种气体就有可能发生反应。
除此之外,化学家们还制得了一大批形式为XeOxY2的化合物,其中x = 1、2、3,Y是任何电负性强的基团,比如-CF3、-N(SO2F)2或-OTeF5。这类化合物范围相当广,可以有上千个之多,并且涉及氙和氧、氮、碳甚至金之间的化学键。一同报道的还有高氙酸、一些稀有气体卤化物和配离子。化合物Xe2Sb2F11中含有目前已知最长的化学键,其中的Xe-Xe键长308.71 pm。
氡化合物氡可与氟反应生成二氟化氡,在固态时会发出黄色光。它与氙的相应化合物类似,但更稳定,更不易挥发。
包合物稀有气体包合物在近几十年曾被广泛研究过,它们由于有可能用于储存稀有气体而引起了人们的兴趣。在这些包合物中,稀有气体原子基本上都是被包容在笼状的主体分子中,即主体分子构成笼状晶格,将稀有气体包藏在笼中。能否形成包合物主要决定于主体分子和客体分子间的几何因素是否合适。例如,氩、氪和氙可以与β-氢醌形成包合物,氦和氖却因为体积太小而无法包合在内。
稀有气体包合物中,研究较多的主体分子是水、氢醌、苯酚和氟代苯酚。
包合物可以用来从稀有气体中分离出He和Ne,及运输Ar、Kr和Xe。此类化合物亦可用作放射源,Kr的包合物是β粒子的安全来源,Xe的包合物则是γ射线的来源。
配位化合物曾经一度认为诸如Ar·BF3之类的配位化合物可在低温下存在,但始终未经实验验证。并且,有报道称化合物WHe2和HgHe2可由电子轰击制得。然而最近的研究表明,它们并不是真正的化合物,He很有可能只是被金属表面吸附。
水合物水合物可由将稀有气体压入水中制得。有理论认为,强极性的水分子使稀有气体原子产生诱导偶极,产生偶极-偶极作用力。因此原子序数较大的稀有气体所形成的水合物,如Xe·6H2O,比原子序数小的稀有气体元素形成的要更加稳定。但2010年来对于这些化合物是否存在产生了疑问。
内嵌富勒烯型包合物稀有气体原子可以被包覆在富勒烯分子中,形成多种多样的内嵌富勒烯型包合物。它们首先在1993年合成。用C60与He或Ne在3bar压力下反应,得到的大约650000个富勒烯分子中,只有一个可以与稀有气体原子形成包合物He@C60或Ne@C60;压力增大至3000bar时,产率增至0.1%。
氢合离子He,Ne,Ar(Kr,Xe,Rn尚未发现)与质子在一定条件下均可制取相应的氢合离子(一种神奇的鎓离子),存在于气态中,通过红外光谱观测到。
氦合氢离子(HeH+)首次发现于1925年,是已知最强的酸,质子亲和能为177.8kJ/mol。有人认为,这种物质可以存在于自然星际物质中。这是最简单的异核离子,它有一个永久的键偶极矩,使它更容易表现出光谱特征。
虽然不同于氦合氢离子,氢和氦构成的中性分子在基态不稳定,但它们的激发态可以作为准分子存在,20世纪80年代中期首次在光谱中观测到。2
应用稀有气体化合物主要被用作氧化剂。这一类型的试剂包括:氙酸、高氙酸盐、三氧化氙。它们被称为所谓“绿色氧化剂”,所参与的反应中,最终还原产物是气态的稀有气体,不会干扰反应,而且比较容易分离。受氧化性影响,氙氟化物容易放出氟,是有机化学中比较新颖高效的氟化试剂,以二氟化氙的用途最广。氙元素稳定的盐中氟和氙的质量分数非常高,比如七氟合氙(VI)酸四氟铵(NF4XeF7)以及类似的(NF4)2XeF8已经被用作火箭推进剂中的高能氧化剂。
由于氪和氙的放射性核素不易储存,因此常将它们以相应化合物的形式来存放及使用。
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国