对于化学反应而言,若反应物和产物都处于标准状态下,则反应过程的熵变,即为该反应的标准熵变。当反应进度为单位反应进度时,反应的标准熵变为该反应的标准摩尔熵变,以△rSm表示。
熵变有关概念1、熵:体系混乱度(或无序度)的量度。S表示熵。也表示黑洞中不可用热量与其温度的比值。
2. 热力学第三定律:对于纯物质的晶体,在热力学零度时,熵为零。
3. 标准熵:1 mol物质在标准状态下所计算出的标准熵值,用STP表示,单位:J·mol-1 ·K-112
化学反应熵变的计算公式一般地,对于反应:mA + nB =xC + yD
DrSmq = 【x Sq,C + y Sq,D】– 【m Sq,A + n Sq,B】
1 可逆过程熵变的计算根据克劳休斯数学表达式可知,如果两平衡态间的过程是可逆的,熵变可用
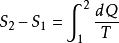
求得(S1和S2分别表示系统在1态和2态的熵).可逆过程熵变可通过n摩尔理想气体从初态
1(P1,V1,T1)变化到末态2(P2,V2,T2)求得.
(1)等温过程 ΔS=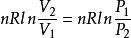
(2)等压过程 ΔS=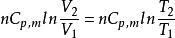
(3)等容过程 ΔS=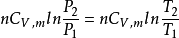
(4)绝热过程 ΔS=0.
(5)可逆循环过程 ΔS=03
2.不可逆过程熵变的计算系统的熵仅与始末状态有关,与过程无关,因此,若始、末两态之间为一不可逆过程,则可以在两态之间设计一个可逆过程,通过计算该可逆过程的热温比积分,得到系统在两个平衡态之间不可逆过程的熵变.
2.1 绝热自由膨胀过程
绝热自由膨胀过程是不可逆过程,该过程中气体对外做功为零,从外界吸热为零,内能增量为零,温度不变,所以绝热自由膨胀过程是一个等温过程,即T1= T2.以n摩尔理想气体从初态1(P1,V1,T1)经绝热自由膨胀过程变化到末态2(P2,V2,T2)为例。ΔS=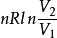
2.2 物质混合过程
以质量为m1、温度为T1的冷水,与质量为m2、温度为T2的热水接触达到热平衡为例,讨论二者的总熵变(设热传导过程中冷、热水系统与外界均无热交换,水的比热为c).由于系统与外界没有能量和物质的传递和交换,所以系统可看成是孤立系统,求总熵即为求系统的熵变.系统在混合过程中,从外界吸收的热量为零,但系统熵变并不为零,所以水温由不均匀到达均匀的过程实际是一个不可逆过程.计算水的熵变(为计算混合前后水的熵变,可假设水的混合过程是可逆的等压过程).
ΔS=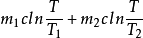
2.3 等压热传导过程
以绝热真空容器中两个完全孤立的不同温度物体经热接触后达到热平衡为例,讨论系统的总熵变.系统与外界没有能量和物质的交换和传递,所以该系统可看作为孤立系统,两物体经热接触后达到热平衡的过程为不可逆过程,压强不变,故在接触前后建立一个等压可逆过程来求解系统的熵变.
ΔS=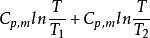
求解熵变应注意的两个问题(1)判别热力学过程是否可逆是解决问题的关键.若为可逆过程,直接用上面给出的公式求解;若为不可逆过程,必须明确不可逆过程中不变的状态参量,然后设计一个该状态参量恒定的可逆过程求解熵变.
(2)若要完整地求解熵变问题,必须熟练掌握各可逆过程中的过程方程、迈耶公式、比热容等常用表达式.3
熵变的大小的影响因素**1)**熵变(ΔS)与体系中反应前后物质的量的变化值有关:
**a.**对有气体参加的反应:
主要看反应前后气体物质的量的变化值即Δn(g),Δn(g)正值越大,反应后熵增加越大;Δn(g)负值越大,反应后熵 减越多;
减越多;
**b.**对没有气体参加的反应:
主要看各物质总的物质的量的变化值即Δn(总),Δn(总)正值越大,熵变正值越大;Δn(总)负值绝对值越大,熵变也是负值的绝对值越大,但总的来说熵变在数值上都不是特别大.
**2)**熵变(ΔS)值随温度的改变变化不大,一般可不考虑温度对反应熵变(ΔS)的影响.
**3)**熵变(ΔS)值随压力的改变变化也不大,所以可不考虑压力对反应熵变的影响.1
熵变和反应方向的关系对于孤立体系而言,在其中发生的任何反应变化必然是自发的。热力学第二定律告诉我们:在孤立体系中发生的任何变化或化学反应,总是向着熵值增大的方向进行,即向着△S孤立0的方向进行的。而当达到平衡时△S孤立=0,此时熵值达到最大。
假如不是孤立体系,则可以把体系与其四周的环境一起作为一个新的孤立体系考虑,熵增原理仍然是适用的。由此可以得出,自发反应是向着0的方向进行的。大家知道,在常压下,当温度低于273K时,水会自发地结成冰。这个过程中体系的熵是减小的,似乎违反了熵增原理。但应注重到,这个体系并非孤立体系。在体系和环境间发生了热交换。从水变成冰的过程中体系放热给环境。环境吸热后熵值增大了,而且环境熵值的增加超过了体系熵值的减小。因而体系的熵变加上环境的熵变仍是大于零的,所以上述自发反应是符合热力学第二定律的。
热力学第二定律:孤立体系(绝热体系)的自发过程是体系熵增加的过程,即:3
状态ISI表示; 状态II用SII表示,所以 DS = SII - SI
DS > 0,过程自发进行;
DS
DS = 0,平衡状态
本词条内容贡献者为:
李飞 - 博士 - 江苏师范大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国