在分析化学中,条件电极电位(conditional electrode potential),简称条件电位。它是在一定,介质条件下,氧化态和还原态的总浓度均为1mol·L-1时,校正了各种因素影响后电对的实际电极电位,它在一定条件下为一常数,不随氧化态和还原态总浓度的改变而改变。
条件电位的大小反映了在外界因素影响下,氧化还原电对的实际氧化还原能力。应用条件电位比用标准电极电位能更正确地判断氧化还原反应的方向、次序和反应完成的程度。
基本性质氧化剂和还原剂的氧化还原能力可以用相关电对的电极电位(简称电位,elecrodepotential)来衡量。电对的电极电位越高,其氧化态的氧化能力越强;反之,电对的电极电位越低,其还原态的还原能力就越强。
此外,氧化还原反应进行的方向和次序取决于相关电对的电极电位大小,氧化剂与还原剂之间自发的反应,总是向着高电位电对中的氧化态物质氧化低电位电对中的还原态物质的方向进行;氧化还原反应进行的完全程度取决于相关电对的电极电位差。因此,电对的电极电位是讨论物质的氧化还原性质的重要参数。
概念引出氧化还原反应电对的电位可用能斯特(Nernst)方程式表示,即
Ox+ne-→Red
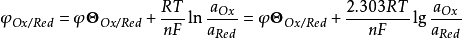
式中:φOx/Red—Ox/Red电对的电位,简写为φ;
φΘOx/Red—Ox/Red电对的标准电位,简写为φΘ;
R—气体常数,8.314J·(K·mol)-1;
T—热力学温度,273.15+t℃;
n—电极反应中的电子转移数;
aOx、aRed—氧化态Ox、还原态Red的活度。
在25℃时,将以上各常数代入上式得(1)式:
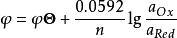
实际工作中,通常知道的是反应物的浓度而非活度,故必须引入相应的活度系数。如果电对的氧化态及还原态还参与酸碱、沉淀或配位等副反应,还必须引入副反应系数,即
aOx=γOx[Ox]=γOxCOx/αOx
aRed=γRed[Red]=γRedCRed/αRed
式中γ、α、[ ]、C分别为氧化态或还原态的活度系数、副反应系数、平衡浓度和分析浓度代入(1)式得:
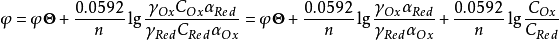
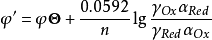
式中φ’称为条件单位(conditional potential),它是在一定条件下,氧化态和还原态的分析浓度均为1mol·L-1时,校正了各种外界因素影响后的实际电位。条件电位与标准电位不同,它的数值与溶液中电解质的种类和浓度,特别是能与电对发生副反应的物质的种类和浓度有关,只有在一定条件下才为一常数。当条件改变时,条件电位将随之改变。例如,Fe3+/Fe2+电对的标准电位φΘ=0.771V,而φ’则不同。1

影响因素凡是影响电对氧化态与还原态的活度系数和副反应系数的各种因素都会使条件电位的大小发生变化,这些因素主要包括离子强度、溶液酸度以及生成沉淀和生成配合物的副反应等。2
离子强度的影响溶液中的离子强度对条件电位的影响称为盐效应。溶液中电解质的浓度变化引起离子强度的改变,进而改变氧化态和还原态的活度系数,最终对氧化还原电对的条件电位产生影响。
在氧化还原反应中,电解质的浓度往往较高,溶液的离子强度较大,氧化态和还原态的价态大多也较高。故盐效应比较显著。但离子活度系数的精确值不易得到,因而离子强度的影响通常难以精确校正。同时,氧化还原体系中的各种副反应对条件电位的影响远比离子强度的影响大,因此,在估算条件电位时,常忽略离子强度的影响,即近似地认为离子活度系数均为1。
溶液酸度的影响溶液酸度对条件电位的影响(称酸效应)包含两个方面:
1、如果电对的半反应中有H+或OH-参加,条件电位的计算式中有H+或OH-的浓度,溶液酸度的变化将直接
影响相关电对的条件电位。
2、如果电对的氧化态或还原态是弱酸或弱碱,其存在形式会受到溶液酸度的影响,溶液酸度的变化将间接引起条件电位的变化。
其他副反应的影响除酸效应外,氧化还原滴定中常见的副反应有生成沉淀和生成配合物的反应。
1、生成沉淀
在氧化还原反应体系中,若有与电对的氧化态或还原态生成沉淀的沉淀剂存在,将会改变电对的条件电位。如果氧化态生成沉淀,条件电位将降低;如果还原态生成沉淀,条件电位将升高。
2、生成配合物
氧化还原电对中的金属离子可与溶液中的某些配位剂发生配位反应,配合物的生成会影响电对的条件电位。如果氧化态的配合物比还原态的配合物稳定,条件电位降低;反之,条件电位升高。在氧化还原滴定中,常利用这一规律,通过加人可与干扰离子生成稳定配合物的配位剂来消除对测定的干扰。
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国