共振论认为,如果一个物质存在两种以上满足共振要求的路易斯结构,这类物质只能用共振式来书写,而且它们实际上综合具有这些结构的特点。每一个共振中的结构称为共振结构或极限结构,而这样的物质看作由共振结构“杂化”而成,称为杂化体。苯的共振式单一路易斯结构中,共价键的键级只能是整数,常与实验数据或量子力学计算所得的结果不符。
来源苯的共振式单一路易斯结构中,共价键的键级只能是整数,常与实验数据或量子力学计算所得的结果不符。根据价键理论,可以写出两种不同的苯分子结构。但是实验表明,苯分子中的C-C键长相等,处于单键和双键之间,与单一的路易斯结构相矛盾。为了解释这个现象,共振论认为苯实际上是这两种结构的杂化体,两种极限结构贡献相等,因此苯的六个碳完全等同。1
简介共振结构之间以双向箭头连接。根据情况不同,每一个共振结构对杂化体的贡献程度不同。共振式中各共振结构的关系可以与正交坐标系中的矢量坐标类比。假设矢量r可以写作xi+yj+zk(x,y,z是分矢量,i,j,k为坐标轴),那么r不是i、j或k中的任意一个,而是它们的特定组合,杂化体也是如此。三个并不存在的共振结构x、y和z,都对杂化体有贡献,而且贡献不同,它们的引入,可以在很大程度上方便理解分析杂化体的结构及性质。1
共振论基本思想共振论是在经典结构式的基础上对π电子离域的共轭分子结构式的书写提出其基本思想的,即π-π和P-π共轭体系分子只用一个电子定域的经典结构式来描述时是无法描述(书写)其真实结构,那就用几个π电子分布不同的经典结构式的叠加或杂化来描述。即用不真实存在的经典结构式(叫共振式或极限式)表达分子的真实结构(共振杂化体)。故共振论更多强调的是结构式上的书写,而且是构造式的书写,不涉及立体结构。在理解共振论时,注意两个概念:每一个经典价键结构式叫极限式或共振式,如下面例子中方括号中的式子,每个极限结构式是不存在的,它只存在于人们的想象中;而所有极限式的叠加或杂化叫共振杂化体,如下面例子中左边的非经典结构,即真实结构。也要注意π电子离域的共轭体系分子真实结构是客观存在的,每一个极限式都不代表这个真实分子结构,能量均高于真实分子,以免出现理解错误。2
共振论与价键理论除了从路易斯结构图上理解物质结构外,共振论还有利于从数学层面上理解价键理论(VB)。当某物质的性质无法用一个价键结构来描述时,即无法以激发、杂化和成键的过程解释,那么共振论的概念便被引入,以便于理解结构。
再次以苯为例。价键理论中,先写出苯分子两种可能的路易斯结构,然后这两种结构线性组合,形成的波函数中含有两种结构各一半的贡献。然而,大多数情况下极限结构的贡献并不相等,这时可通过变分最优化先求得波函数的最低能量,作为最佳近似值得到贡献的系数,再由此近似估计分子的真实结构。1
共振论与分子轨道理论在更复杂的分子轨道理论中,共振通常是π轨道中电子离域的同义词。比如苯分子中,分子轨道示意图表明6个π电子离域在6个碳原子上,碳-碳键键级超过单键,整个分子以正六边形环外加中心的圆来表示更加妥当。一般教学中,常混合价键理论和分子轨道理论的思想,认为C-C之间不只存在σ键,而且还包括π电子的离域。1
共振论与杂化轨道理论杂化轨道理论在有机化学学习中起着十分重要的作用,对有机化合物σ和π键的形成都能很好的解释,但是在书写复杂共轭体系分子结构式时,经典结构式就遇到了困难;共振论因为是从经典结构理论引申出来的,因此与经典结构理论很相似,但是共振论的最大价值在于它能够用较简单的结构式表达复杂的离域分子。只是由于共振论是在经典结构的基础上,不考虑电子的运动状态和分子的立体结构的问题,加之书写极限式个数随意性很大,因此在应用上有一定的局限性。2
共振结构式书写原则因为共振论不能完全摆脱价键理论的固有局则———构造式的核不动,未成键电子数不变。当然书写极限式的技巧可以简单归纳为:先写一个熟悉的极限式,然后将离域所涉及的电子一般为P电子沿碳链或沿碳环走一圈,单键与双键互变,就可把可能的极限式书写出来。
书写中注意表达式之间:
1、各极限式用双箭头连接起来,所有的共振式用方括号括起来;
2、用弯箭头表示电子对的移动。
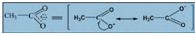 如:乙酸根的真实结构是2个极限式的共振杂化体:2
如:乙酸根的真实结构是2个极限式的共振杂化体:2
共振式与互变异构共振式需要注意的是,每个极限结构实质上并不存在,杂化体具有单一特定的结构,也并不是极限结构的混合物或平衡体系。只是任何一个路易斯结构都无法准确地表达物质的结构,只有用极限结构杂化的思想来表达才更加确切。因此共振式与互变异构是截然不同的两个概念,互变异构涉及原子位置的改变,而共振式则不然。1
共振能共振能杂化体的能量总是低于各极限结构,常用共振能的概念来表示该降低值。它被定义为杂化体能量低于最稳定极限结构能量的数值,常与另一个概念离域能混用。电子的离域降低了轨道能,增加了分子的稳定性,常会造成分子的芳香性,如苯。
共振能随着极限结构数的增多而增大,尤其是存在等价极限结构时(能量相等)。可由量子化学计算、热化学方法或分子的氢化热来估计共振能。例如,氢化苯的一个双键约需120kJ/mol的能量,乘以3得到苯的完全氢化需要的能量,大概为360kJ/mol。实验测得苯的氢化热只有210kJ/mol,因此,共振能便是剩下的150kJ/mol。
共振能可用于计算鲍林标度下的电负性。1
本词条内容贡献者为:
杨剑虹 - 教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国