邻基参与效应,有机化学概念之一,指的是相邻基团含有的σ键、π键电子或孤对电子与反应中心发生作用,使反应的某些性质发生改变的现象。
定义邻近基团参与,简称邻基参与(neighboringgroupparticipation,NGP)是饱和碳原子上亲核取代反应中一种常见现象,邻基参与效应不仅能导致反应速度的加快和重排的发生,而且还可控制反应的立体化学,因而在有机合成中得到广泛应用。能够产生邻基参与效应的基团通常含有带孤对电子的原子(如氧、硫、氮和卤原子等),或是具有π电子的基团(如苯环、碳碳双键等)。这些具有孤对电子或π电子的基团在反应过程中能够作为亲核试剂优先发生分子内的亲核取代,形成的不稳定环状中间体再接受亲核试剂的进攻,得到稳定的取代产物。1
分类及机理(1)氧原子的邻基参与1
羧基的氧原子容易发生邻基参与。例如,(S)‐2‐溴代丙酸在氢氧化钠水溶液中水解生成构型保持的(S)‐2‐羟基丙酸,反应具有立体专一性:
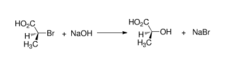
在这个过程中,羧基与碱作用首先形成羧酸根阴离子;然后,羧酸根阴离子亲核进攻α‐碳,发生分子内的SN2反应,形成不稳定的α‐内酯中间体;后者继而与氢氧根发生分子间的SN2反应,生成最终的亲核取代产物2‐羟基丙酸。由于经历了两次SN2反应,故两次构型翻转的结果是构型保持。

酯基的氧原子亦容易发生邻基参与效应。例如,反‐1‐乙酰氧基‐2‐对甲苯磺酸酯基环己烷在醋酸中与醋酸钠的亲核取代反应速率比其顺式异构体快1000倍,而且得到构型保持的取代产物,而顺式异构体反应生成构型翻转的产物。
羟基(OH)、烷氧基(OR)、亚砜(S=O)等基团的氧原子也是邻基参与的常见基团。
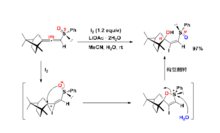
(2)硫原子的邻基参与1
与氧相比,硫具有更强的亲核性,故也容易发生邻基参与效应。1‐苯硫基‐2‐氯环己烷在THF中水解时,反式异构体因具有邻基参与效应,要比顺式异构体的反应快105倍,且立体选择性地生成构型保持产物。
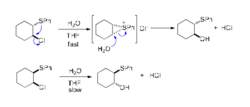
(3)氮原子的邻基参与2
与氧和硫相似,拥有孤对电子的氮原子也能发生邻基参与,例如,N‐乙基‐2‐氯甲基吡咯烷能够通过氮的邻基参与发生扩环,生成N‐乙基‐3‐氯六氢吡啶:
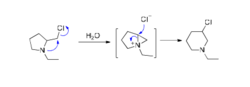
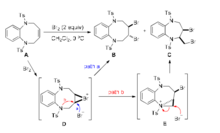
氮的邻基参与能力很强,即使氮原子上连有吸电子基团,也可发生邻基参与。如下化合物A在加溴时,除了得到正常的反式加成产物B外,还得到一种重排了的二溴化合物C。在此过程中,第一步所形成的溴鎓离子中间体D被溴离子进攻,得到加成产物B(patha);
D中磺酰胺的氮原子通过邻基参与,形成吖丙啶鎓离子E(pathb),后者经溴离子进攻开环得到C。
(4)芳环的邻基参与1
具有6π电子体系的苯环是常见的邻基参与基团。苯环的邻基参与经历了一个具有螺环结构的苯鎓离子(phenoniumion)中间体,共振导致了这种苯鎓离子中间体比较稳定。实际上,苯鎓离子在超酸中相当稳定,以至于可用NMR来测定其结构。苯环的这种邻基参与效应得到了立体化学研究结果的支持。例如,在如下2‐苯基‐3‐对甲苯磺酸酯基丁烷的溶剂解反应中,赤式底物生成了一种赤式的取代产物和少量消除产物,而苏式底物则得到外消旋的苏式产物和少量消除产物。
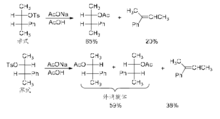
这组反应的立体化学可通过如下邻基参与机理来解释:
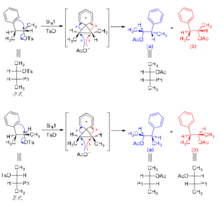
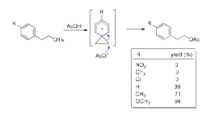
既然邻基参与的基团是电子的给体,那么越富电子的基团邻基参与效应越显著。例如,在下述苯磺酸酯的溶剂解反应中,苯环上连有吸电子基团(硝基、三氟甲基或氯)时,反应不发生。当苯环上无取代基或连有给电子基团(甲基、甲氧基)时,反应容易进行,而且给电子作用越强,反应速度越快。显然,给电子基团稳定了苯鎓离子中间体,从而使反应容易进行。相反,吸电子基团的去稳定化作用导致了邻基参与不能发生。
(5)C=C键的邻基参与
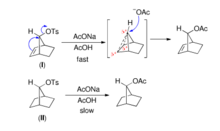
烯烃能提供π电子而产生邻基参与效应。例如,在下述两个桥环化合物的溶剂解反应中,具有双键的磺酸酯(I)比无双键的磺酸酯(II)反应快1011倍。1
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国