银锌蓄电池是一种碱性蓄电池,突出优点是体积小、重量轻、容量大。例如15XYG-45型银锌蓄电池的重量只有12HK-28型电池的60%,而容量则为它的1.7倍。银锌蓄电池还有放电电压平稳和自放电小等优点,银锌蓄电池的缺点是寿命短,容易产生内部短路故障,而且造价很高。1
发展历程这种电池是由一系列圆形锌片和银片相互交迭而成的装置,在每一对银片和锌片之间,用一种在盐水或其他导电溶液中浸过的纸板隔开。银片和锌片是两种不同的金属,盐水或其他导电溶液作为电解液,它们构成了电流回路。这是一种比较原始的电池,是由很多银锌电池连接而成的电池组。
经过了200多年的更迭,银锌蓄电池至今仍然出现在我们的手表、计算器等低耗电设备中。既然银锌蓄电池有那么久远的历史,为什么至今才被当作锂电池最有希望的接班人推出?其实自问世以来,民用的银锌电池就只能提供较低的电压和电流,电池容量也相当小。普通的锌银电池的正极是氧化汞加石墨,或者是氧化银加石墨,负极材料是金属锌,电解质是强碱氢氧化钾。普通银锌电池性能稳定,不可充电,占据了纽扣电池市场的半壁江山。在上世纪七十年代,人们才开发出了银锌蓄电池。银锌蓄电池正极采用Ag2O2 + 2H2O + 4e→2Ag + 4OH-,负极采用2Zn + 4OH- →2Zn(OH)2 + 4e,可以拥有极高的电容量和稳定的电池性能。大容量银锌蓄电池价格惊人,在当今的航天飞机、导弹、鱼雷等尖端领域才能找到大容量银锌蓄电池的身影。
 对于数码设备来说,在不考虑成本的情况下,银锌蓄电池将会使最佳的选择。为了实现银锌蓄电池低价化的目标,一家叫做Zinc Matrix的公司自1999年开始就在风险投资的助力下开发低成本长寿命的银锌充电电池。经过了几年的努力,在2006年Intel信息技术峰会上,Zinc Martix展出了它们首个民用银锌充电电池原型。初次展出的该款电池只有1.6V电压,但电池容量可以达到10AH。在随后的两年间,Zinc Martix改名为ZPower,继续从事银锌电池的改良设计。2008年5月ZPower公司宣布旗下的银锌充电电池在同等体积下能获得超过锂电池30%~40%的电容量,并且较后者更安全耐用。
对于数码设备来说,在不考虑成本的情况下,银锌蓄电池将会使最佳的选择。为了实现银锌蓄电池低价化的目标,一家叫做Zinc Matrix的公司自1999年开始就在风险投资的助力下开发低成本长寿命的银锌充电电池。经过了几年的努力,在2006年Intel信息技术峰会上,Zinc Martix展出了它们首个民用银锌充电电池原型。初次展出的该款电池只有1.6V电压,但电池容量可以达到10AH。在随后的两年间,Zinc Martix改名为ZPower,继续从事银锌电池的改良设计。2008年5月ZPower公司宣布旗下的银锌充电电池在同等体积下能获得超过锂电池30%~40%的电容量,并且较后者更安全耐用。
银锌蓄电池的工作原理银锌蓄电池在充好电后,其正极板的活性物质是过氧化银(Ag2O2),负极板的活性物质是锌,电解液是以氢氧化钾为主,并配以锌酸盐的饱和水溶液。放完电后,正极板的活性物质变为银,负极板则变为氢氧化锌[Zn(OH)2]。
放电时,在负极锌与电解液中的氢氧根离子化合,生成氢氧化锌,并放出两个电子,其化学反应式为:
Zn+2OH-→Zn(OH)2+2e
在正极,化学反应分两个阶段进行。第一阶段,过氧化银获得电子并与水化合,生成氧化银(Ag2O)和氢氧根离子,其化学反应式为:
Ag2O2+H2O+2e→Ag2O+OH-
当放电进行到一定程度时,转入第二阶段,氧化银又获得电子,并与水化合,生成银和氢氧根离子,其化学反应式为:
Ag2O+H2O+2e→2Ag+OH-
与此同时,生成的银还会与过氧化银进行如下反应:
2Ag+Ag2O2→2Ag2O
综合以上4个反应式,得到放电时的化学反应式如下:
Ag2O2+ 2Zn + 2H2O→2Ag + 2Zn(OH)2
从上述化学反应过程可知,在放电时负极板上的锌被氧化,生成氢氧化锌,同时消耗掉氢氧根离子;正极板上的过氧化银被还原,先生成氧化银,继而生成银,同时消耗掉水,并产生氢氧根离子;电解液中的氢氧化钾并无消耗掉,离子钾和离子氢氧根仅是在两极间起输送电能的作用,但水则参与化学反应,不断被极板吸收,氢氧化钾的浓度越来越大。
银锌蓄电池的化学反应也是可逆的,故充、放电的化学反应式为:
Ag2O2+ 2Zn + 2H2O 2Ag + 2Zn(OH)2 1
2Ag + 2Zn(OH)2 1
银锌蓄电池的放电特性电动势银锌蓄电池电动势的变化,主要受正极板的化学反应阶段性影响,而与电解液的密度无关。 银锌蓄电池正、负极的电极电位φ与氢氧化钾百分比浓度N的关系如图1所示。从图中可以看出氢氧化钾浓度变化(相当于密度变化)时,正、负极的电极电位都要变化,但它们的差值即电池的电动势基本保持不变。因此,银锌蓄电池的电动势与电解液的密度无关。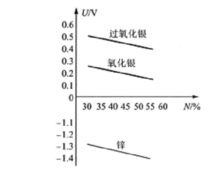
从图1中可以看出,银锌蓄电池的电动势随正极活性物质的变化而有所不同。在放电过程中的第一阶段,正极的电极电位主要取决于过氧化银的电极电位。但在放电过程中,部分过氧化银生成氧化银,氧化银的电极电位较低,所以正极电极电位逐渐下降,因此电动势随正极电极电位的下降而减小。放电过程的第二阶段,正极电极电位变成以氧化银的电极电位为主,电极电位有所降低,因此电动势仍将继续下降,但比第一阶段缓慢。1
内电阻与铅蓄电池一样,银锌蓄电池的内电阻也由极板电阻、电解液电阻和极板与电解液的接触电阻组成。由于银锌蓄电池在充、放电过程中不消耗氢氧化钾,因此内电阻的变化受电解液的影响较小,主要由极板生成物质的电阻决定。例如在放电过程的第一阶段,正极板生成阻值较高的氧化银,负极板也部分被氢氧化锌所遮盖,因此内电阻将逐渐增大。笫二阶段由于正极板生成导电性很好的银,因此内电阻反而有所减小。1
放电电压放电时电压的变化情形如图2所示,银锌蓄电池的放电电压也有明显的阶段性。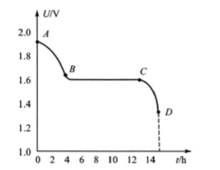
放电过程的第一阶段,一方面电动势要减小,一方面内压降随内电阻的加大而增大,因此端电压下降较快,如图中AB段。第二阶段电动势继续下降,但比较缓慢,而内压降则随内电阻的减小而减小,因此端电压保持不变,如图BC中段。到C点以后,剩下的活性物质已经很少,若过量放电,端电压将迅速降低到D点或0伏,单体电池的终了电压一般取1.3-1.1 V。
由于放电的第二阶段有银与过氧化银结合,生成氧化银后参与放电反应,所以这个阶段持续的时问一般都大于放电总时间的70%,成为放电的主要阶段。1
银锌蓄电池的充电充电电压XYG-45型单体电池以4.5A电流充电时,其电压曲线如图3所示。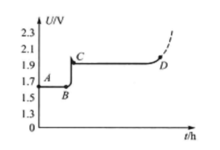
充电电压特性曲线具有明显的阶段性。这主要是由正极化学反应的阶段性决定的。第一个平阶对应于曲线AB段,负极板的部分氢氧化锌还原成锌,正极板的银氧化为氧化银,电压基本稳定在1.62-1.64V之间。到B点时,正极板表面被氧化银所覆盖,电解液扩散困难,极板里层孔隙中的化学反应处于停滞状态,电压跃升到C点,然后转为第二个平阶对应于曲线CD段,负极板的氢氧化锌继续还原为锌,正极板的氧化银再氧化为过氧化银。由于过氧化银的导电性能比氧化银好,所以电压升高到生成过氧化银的C点以后,充电电压先要稍微下降,而后由于电动势要缓慢上升,内电阻逐渐减小,因此电压基本保持在1.92 V左右,直到D点为止。D点以后,极板上的活性物质已基本还原,若继续充电,电压将迅速升高,并开始电解水,正、负极板周围分别冒出氧气和氢气,甚至会产生火灾等危险。一般充电到2.05V即为终了电压,应停止充电。如果过量充电,还会造成内部短路等故障。1
充电方法(1)正常充电
蓄电池完全放电后,先用8 A电流充电4 h,然后再用4 A电流充电6 h。寿命后期,因容量减小,一般充不到10 h,应在充电到终了电压2.05 V时停止。
(2)补充充电
对半放电的蓄电池可用4.5 A的电流进行补充充电,充到终了电压为止。
(3)紧急充电
在急需的情况下。可用22.5 A电流充电到2 V,然后保持当时的电压继续充电3 h。
(4)初次充电
银锌蓄电池以干放电状态出厂,启用时要经过灌注电解液、浸泡、化成、检验容量和充电检查等步骤以后方能使用。
(5)化成
进行两个充、放电循环,使活性物质充分活化,以获得良好的供电能力。
(6)检查容量
以45 A电流放电到终了电压,放电时间不应少于54 min。
(7)充电检查
正常充电后放置24 h,检查每个单体电池的电动势,若低于1.82 V,说明存在内部短路故障,应予更换。
初次充电总共需要4-6天,所以在飞机上启用银锌蓄电池需要一定的时间提前量。1
充电时应注意的几个问题要及时调整充电电流,一般每小时检查并凋整一次,充电到实有容最的90%以后,应勤加检查,防止过量充电。不允许并联充电,以免有些电池过量充电。充电间不允许放置酸性蓄电池和其他酸性物质。1
银锌蓄电池的主要故障银锌蓄电池常见的主要故障是内部短路。单体电池短路时将出现这些现象,即充电电压很低或开路时电动势迅速降低,温度则迅速升高,导致极柱上的焊锡熔化,连接条烧红,塑料外壳变形,冒电解液,散发出难闻的气味。造成内部短路的直接原因有:
(1)极板上端出现海绵状锌而短路。
(2)锌酸盐在负极沉积,生成锌枝,穿透隔板,延伸到正极而短路。
(3)氧化银溶解后,在隔板上沉积,使隔板强烈氧化,同时氧化银生成金属银微粒,使隔板失去绝缘性而短路。
前两种短路主要是由于过量充、放电所致。过量充电时,正、负极分别产生氧气和氢气,再加上温度高,气体膨胀,不断上移逸出,于是海绵状锌被挤压到极板上端而短路;过量充电时,电解液中的锌酸根离子会在负极板上逐步沉积,形成树枝状的锌枝。
至于氧化银对隔板的氧化损坏,主要是蓄电池在充足电和高温下,较长期保存所致。为此,应尽量防止充足电的蓄电池在高温下搁置。如果预计一个月内不使用蓄电池,应在放电状态下保存,这一点与铅蓄电池不同。1
本词条内容贡献者为:
蒲富永 - 教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国