简介
使液体表面积增大的过程是克服液相分子吸引力, 使体相分子转移到表面相的过程,需要环境对体系做功。以可逆方式做功最少,称之为表面功。
增大液膜面积dAS,需抵抗力F,作非体积功——表面功。可逆条件下,忽略摩擦力,则为可逆表面功。

其中, 。
。
 的意义:使液体增加单位表面积时,环境所需作的可逆功→表面功。单位J·m-2。
的意义:使液体增加单位表面积时,环境所需作的可逆功→表面功。单位J·m-2。
举例来说,表面功是由凝聚态物体的表面积改变所做的功。
例如水滴长大要对抗其表面张力σ而做功。要使表面积增加dS,则此时的表面功为W表面=σdS或W表面=∫σdS。
在热力学中常规定体系对外界做功,功取负值,外界对体系做功,功取正值。1

表面Gibbs函数恒温恒压下:



σ=系统增加单位面积时所增加的G →(比)表面Gibbs函数,J·m-2。
表面张力举例用肥皂液在一个系有线圈的金属环上形成一个液膜,由于线圈周围都是相同的液体,受力均衡,线圈可以在液膜上自由移动位置。

若将线圈内液膜刺破,线圈两边受力不再平衡,立即绷紧成圆形。

这些现象表明,在液体表面存在一种使液面收缩的力,称表面张力(surface tension)或界面张力(interfacial tension)。
表面张力的方向和表面相切,是垂直作用在表面上单位长度线段上的表面收缩力。
表面层分子受力 表面层分子与体相内分子所处的力场不同。主要受到指向液体内部的拉力,使表面层液体分子有向液体内迁移、力图缩小表面积的趋势。液滴→球形。若扩大表面积,对系统作功。

物理意义表面张力,单位面积的表面功,单位面积的表面Gibbs函数,不同物理量有相同的数值和量纲。
因为1 J =1 N·m→1 J·m-2 =1 N·m-1 其它界面有界面张力。
与吉布斯自由能的关系由吉布斯自由能性质可知,在恒温恒压下,此表面功即等于体系吉布斯自由能的变化量的相反数:
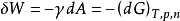
此式表明,考虑表面相贡献的多相体系,除了温度、压力、组成等因素,表面积也是影响体系热力学函数的一个重要变量。2




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国