定义
系统由一个状态到达另一个状态的变化过程称为热力过程,简称过程。状态改变意味着系统原平衡态被破坏。实际热工设备中进行的过程,都是由于系统内部各处温度、压力或密度的不平衡而引起的,所以过程所经历的中间状态是不平衡的。1
如果在热力过程中系统所经历的每一个状态都无限地接近平衡态,这种过程称为准平衡过程,又称为准静态过程,在状态参数坐标图上可以用连续的实线表示。而非平衡过程由于它所经历的不平衡状态没有确定的状态参数,因而不能表示在状态参数坐标图上。1
图像表示如果用坐标轴代表某两个状态参量,则体系的任意平衡态可以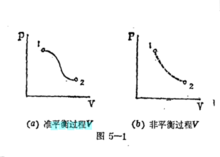 用图上的一个点来描写,非平衡态却不能如此描写,因为非平衡态至少有一个参量是不存在确定值的。2
用图上的一个点来描写,非平衡态却不能如此描写,因为非平衡态至少有一个参量是不存在确定值的。2
准平衡过程可以在PV图上用实线描述,非平衡过程则用虚线代表,它不能用PV图描述。在准平衡过程中,体系的状态参量不仅有明确的数值,而且与外界的相应参数(如压强)数值相同。2
准平衡过程中的功计算准平衡过程中的功的典例。设有一气缸,活塞的截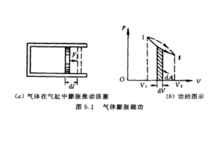 面积为S。随着气体膨胀,活塞移动了dl后,气体所做的元功为:
面积为S。随着气体膨胀,活塞移动了dl后,气体所做的元功为: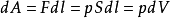 ,式中dV为气体容积的改变。设气体从状态Ⅰ变化到状态Ⅱ,在图中以实线Ⅰ和Ⅱ表示;功dA可以用画有阴影的小面积来表示。从状态Ⅰ变化到状态Ⅱ,气体总功基本等于上述小面积的总和,即曲线下的面积:
,式中dV为气体容积的改变。设气体从状态Ⅰ变化到状态Ⅱ,在图中以实线Ⅰ和Ⅱ表示;功dA可以用画有阴影的小面积来表示。从状态Ⅰ变化到状态Ⅱ,气体总功基本等于上述小面积的总和,即曲线下的面积:
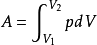 。
。
当气体膨胀,系统对外界做功时,A>0。当气体被压缩,外界对系统做功时,A




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国