离子晶格(ionic crystal lattice)是晶体结构中质点间的结合以离子键占主导地位的晶格。组成离子晶格的质点是离子(包括络离子),阳离子大多具有中等数值(6左右)的配位数。离子晶格晶体一般表现为透明或半透明,具非金属光泽,硬度和熔点一般较高,是电的不良导体,但熔融或溶解后能导电。1
特点及其性质离子晶格其质点为离子,典型的离子晶体为氯化钠(NaCl),氯离子(C1-)与钠离子(Na+)。阴离子半径远远大于阳离子半径,所以可以认为紧密堆积的几何形状主要取决于阴离子的半径。因此,在离子晶格中可以视为阴离子的最紧密堆积,阳离子可以看成是充填于空隙之中,阴阳离子间距则取决于两者半径之和,为了使格子构造具有最好的位能。2
在这类晶格中,结构单位为得到和失去电子的阴、阳离子,它们之间靠静电引力相互联系起来,从而形成离子键。它们的电子云一般不发生显著变形而具有球形的对称,即离子键不具有方向性和饱和性。因此,结构中离子间的相互配置方式,一方面取决于阴、阳离子的电价是否相等;另一方面取决于阳、阴离子的半径比值。通常阴离子呈最紧密或近于最紧密堆积,阳离子充填于其中的空隙并具有较高的配位数。 离子晶格中,由于电子都属于一定的离子,质点间的电子密度很小,对光的吸收较少,易使光通过,从而导致晶体在物理性质上表现为低的折射率和反射率、透明或半透明、具非金属光泽和不导电(但熔融或溶解后可以导电)等特征。晶体的机械性能、硬度与熔点等则随组成晶体的阴、阳离子电价的高低和半径的大小有较宽的变化范围。3
离予晶格具有下列性质:
1.由于离子间没有自由电子存在,故离子晶体为电的不良导体。但熔融后可形成自由移动的离子,因此熔体又具导电性。
2.因离子键的键力比金属键、分子键都强,因此离子晶体,一般地说硬度、熔点、机械强度部较高,多为非金属光泽、折光率不高,往往透明和半透明。
3.由于离子晶格是由阴阳离子组成,而水分子(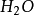 )为极性分子,所以离子晶格的矿物比金属晶格和原子晶格的矿物在水中的溶解变要大得多。
)为极性分子,所以离子晶格的矿物比金属晶格和原子晶格的矿物在水中的溶解变要大得多。
自然界中绝大多数矿物为离子晶体。绝大多数含氧盐,常见的氧化物、氢氧化物及卤化物类矽物,均属离子晶格类型。
离子晶格类型一般说来.获得电子的负氧离子半径比失去电子的阳离子大。故大的负氧离子基本上呈密排结构,占领面心立方结构中的顶点和面心位置。如果半径较小的金属离子全部占据八面体空隙,则氧离子与金属离子数的比例为1:1,即形成MO形式的氧化物。若金属离予全部占领四面体空隙,则氧离子数与金属离子的比例为1:2即形成MO形式的氧化物。4
1.MaCl型结构
如NaCl晶体中的Na+,Cl-的离子半径比为6配位,晶体的基本 结构基元为NaCl6八面体,从八面体在晶体中的结晶方位来分析,八面体的顶角为Cl-,在{100}面显露,八面体的面与晶体中八面体0{111}相平行,见图6.1-9,NaCl晶体腐蚀像中也显示了晶体结构的特征。在{100}面腐蚀为四方形,在{111}面则显示三方锥,在{110}面为不等边的三角锥,它们是NaCI6八面体在该面的显露,见图6.1-10。4
结构基元为NaCl6八面体,从八面体在晶体中的结晶方位来分析,八面体的顶角为Cl-,在{100}面显露,八面体的面与晶体中八面体0{111}相平行,见图6.1-9,NaCl晶体腐蚀像中也显示了晶体结构的特征。在{100}面腐蚀为四方形,在{111}面则显示三方锥,在{110}面为不等边的三角锥,它们是NaCI6八面体在该面的显露,见图6.1-10。4
2.闪锌矿型结构如图6-11所示。 如果氧离子呈密排立方结构,而金属离子只填充四面体空隙的一半则可能形成如图6—11闪锌矿(ZnS)结构。具有这种结构的化合物有ZnS、BeO和SiC等。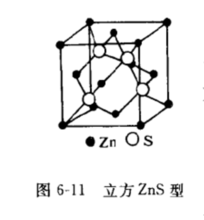
3.萤石型结构与逆萤石型结构如图6—12所示。若金属离子如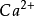 呈密排(紧密堆积)面心立方结构,而非金属离子填满其中的四面体空隙,则形成典型的萤石(
呈密排(紧密堆积)面心立方结构,而非金属离子填满其中的四面体空隙,则形成典型的萤石(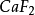 )结构4。
)结构4。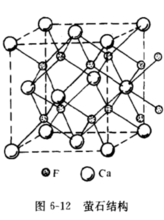
本词条内容贡献者为:
胡建平 - 副教授 - 西北工业大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国