其中R为溶质,Mm+和Nn-分别为电离出来的阳离子和阴离子,其离子积可表示为:
K=[Mm+]n**·**[Nn-]m1
离子积离子积常数是化学平衡常数的一种形式,多用于纯液体和难溶电解质的电离。
形如这样的一个电离方程式:

其中R为溶质,M和N分别为电离出来的阳离子和阴离子,其离子积可表示为:
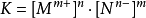
与一般的平衡常数表达式相比,离子积常数的表达式少了关于反应物的项。这就限制了离子积常数只适用于反应物是纯液体或纯固体的反应,因为在计算平衡常数时,纯液体和纯固体的浓度视作1。
纯液体的离子积纯液体的离子积一般用于溶剂的自耦电离,如水。水是一种极弱的电解质,它能微弱地电离:
H2O + H2O ↔ H3O+ OH
通常H3O简写为H。
水的离子积Kw=[H]·[OH],25度时,Kw=1×10。温度升高时,水的电离程度加大,Kw值也随着上升。
液氨、液态二氧化硫等溶剂也可写出离子积表达式。
难溶电解质的离子积难溶电解质的离子积常数能很好地反映电解质的溶解程度,因此这一种常数又叫做溶度积常数,符号为Ksp。
如氯化银的微弱电离:
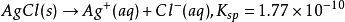
即在25℃的AgCl的饱和溶液中,银离子浓度与氯离子浓度的乘积为1.77E-10。根据这一点,可以计算出AgCl的溶解度。
在1“分子”溶质电离出离子数相同的情况下,Ksp越小的,溶解度也越小。
在不同温度下,同一物质的Ksp会有不同的数值。
水的离子积原理在一定温度下,水中[H ]和[OH-]的乘积(Kw)是一个常数,这个常数叫做水的离子积(曾用名:离子积常数)。水的离子积又叫水的自电离常数,即为水的电离[H2O(l) H +(aq) OH-(aq)]达到平衡后平衡常数。
水是纯液体,[H2O]可看作是一个常数,所以Kw=[H+ ][OH-]。Kw值跟温度有关,在25℃,Kw=[H+ ][OH-]=1×10^-7×1×10^-7=1×10^-14。为了计算简化,常常把这个值作为室温下水的离子积。在物质的稀水溶液中,[H2O]和纯水的[H2O]几乎相同,因此Kw也几乎相等。这就是说,在任何酸性(或碱性)溶液中,同时存在H 和OH-,只不过[H ]和[OH-]的相对大小不同而已。在常温下,[H +]和[OH-]的乘积等于1×10^-14。因此,水溶液的酸碱性只要用一种离子(H +或OH-)的浓度表示。
水是一种既能释放质子也能接受质子的两性物质。水在一定程度上也微弱地离解,质子从一个水分子转移给另一个水分子,形成H3O+和OH-。
达到平衡时,可得水的离解常数Ki
或[H2O+][OH-]=Ki[H2O]
由于水的离解度极小,[H2O]数值可以看作是一个常数,令K1[H2O]2等于另一新常数Kw,则
[H3O+][OH-]=Kw
Kw称为水的离子积常数,简称水的离子积。上式表示在一定温度时,水中氢离子浓度与氢氧离子浓度的乘积为一常数(表3-1)。25℃时,由实验测出在纯水中[H3O+]和[OH-]各为1.0×10^-7mol/L。通常将水合离子H3O+简写为H+,这样,在常温时:Kw=1.0×10^-7 × 1.0×10^-7=1.0×10^-14 [H+][OH-]=1.0×10^-14
离子积随温度变化表3-1 不同温度时水的离子积
|| ||
由于水离解时要吸收大量的热,所以温度升高,水的离解度和Kw也相应地增大。
水的离子积原理不仅适用于纯水,也适用于一切稀的水溶液。在任何稀的水溶液中,不论[H+]和[OH-]怎样改变,它们的乘积总是小于等于Kw。
也就意味着有PH14的物质,当然前提是温度足够高。
溶液的PH值PH值的引入在纯水或中性溶液中,25℃时
当向水中加入酸时,溶液中[H+]就会增大,设达到新的平衡时该溶液的[H+]为1.0×10-2mol/L,因[H+][OH-]=1.0×10-14,则
可见,在酸性溶液中,[H+]>1.0×10-7 mol/L,而[OH-]1.0×10-7mol/L,而[H+]1.0×10-7 mol/L>[OH-]
在碱性溶液中[H+]




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国