定义:物质(包括离子)的当量用克/克当量做单位,叫做克当量。
符号:E。
用毫克/毫克当量做单位,叫做毫克当量,简称毫当量,符号mEq.因为1克=1000毫克,所以1克当量=1000毫克当量。
酸和减的克当量酸和碱克当量的概念强酸强喊中和反应的实质是:
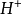 +
+ ⇌
⇌
因此1摩尔的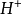 离子需1摩尔的
离子需1摩尔的 离子来中和。但不同的酸碱发生中和反应时它们的质量关系又是什么呢?为 了研究方便,先讨论中和1摩尔**(****40克) NaOH所需几种酸的摩尔数及其所提供离子的摩尔数和质量关系。由下表数据可知,尽管中和1摩尔(40克)NaOH所需
离子来中和。但不同的酸碱发生中和反应时它们的质量关系又是什么呢?为 了研究方便,先讨论中和1摩尔**(****40克) NaOH所需几种酸的摩尔数及其所提供离子的摩尔数和质量关系。由下表数据可知,尽管中和1摩尔(40克)NaOH所需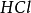 ,
,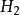
 和
和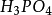 摩尔数不同,但1摩尔
摩尔数不同,但1摩尔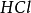 ,
, 摩尔
摩尔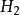
 ,
, 摩尔
摩尔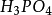 所提供离子的摩尔数是相同的。不同的酸摩尔质量不同,提供1摩尔离子所需酸的质量也不同。我们把在化学反应中提供1**摩尔
所提供离子的摩尔数是相同的。不同的酸摩尔质量不同,提供1摩尔离子所需酸的质量也不同。我们把在化学反应中提供1**摩尔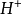 离子所需酸的质量叫做该酸的克当量。例如
离子所需酸的质量叫做该酸的克当量。例如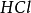 ,
, 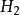
 和
和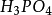 的克当量分别为36.5克,49克和32.7克。
的克当量分别为36.5克,49克和32.7克。
同理,在化学反应中提供1摩尔离子所需的碱的质量叫做该碱的克当量。如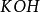 ,
,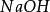 ,
,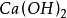 的克当量分别为56.1克,40克,37克。
的克当量分别为56.1克,40克,37克。
分析表中酸的摩尔质量,1摩尔酸提供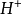 离子的摩尔数及酸的克当量,三者的 关系为
离子的摩尔数及酸的克当量,三者的 关系为
酸(碱)的克当量=酸(碱)的摩尔质量 / 1摩尔酸(碱)提供的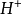 (
( )摩尔数
)摩尔数

酸减克当量的本质 —克当量的广义概念我们已经知道,提供1摩尔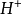 离子所需酸的质量叫做酸的克当量。提供1摩尔
离子所需酸的质量叫做酸的克当量。提供1摩尔 离子所需碱的质量叫做碱的克当 量:而1摩尔
离子所需碱的质量叫做碱的克当 量:而1摩尔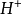 离子和1摩尔
离子和1摩尔 离子 都带1摩尔单位电荷。所以,我们可以说在 反应中能提供1摩尔单位电荷所需酸(碱)的质量叫做酸(碱)的克当量。
离子 都带1摩尔单位电荷。所以,我们可以说在 反应中能提供1摩尔单位电荷所需酸(碱)的质量叫做酸(碱)的克当量。
中和反应是一种复分解反应,离子都带有电荷,可见酸碱克当量的概念,可推广到复分解反应中去,即在复分解反应中,每交换摩尔单位电荷所需物质的质量就是该物质的克当量。
在氧化——还原反应中,氧化剂和还原剂发生了电子的传递,如:
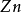 +
+ =
= +
+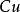
(还原剂)(氧化剂)
所以,对氧化剂和还原剂来说,每传递1摩尔的电子所需氧化剂或还原剂命的质量就是它的克当量。
综上所述,克当量的广义概念应为交换或传递1摩尔单位电荷所需某物质的质量。
即克当量=物质的摩尔质量 / 1摩尔物质交换或传递电荷的摩尔数
这个关系式,既适用于求复分解反应 中各物质的克当量,又适用于求氧化还原反应中各物质的克当量。并且便于根据物质参加反应时的具体情况计算各物质的克当量。1
计算克当量时应注意的几个问题当量定律指出:两种物质总是以等克当量数进行化学反应的。实际上,不仅反应物与反 应物之间.而且反应物与生成物之间,生成物与生成物之间也都是等克当量数的。这一规律 经常被用在化学计算中,以使计算来得简捷、准确。但是,在具体应用时,首先遇到的向题 是计算各物质的克当量。计算化合物的克当量时,大家都习惯于应用公式:化合物的克当量 =化合物的摩尔质量/化合物的正(负)价总数。而很多人在利用这个公式时,忽视了两个 重要向题:一个是同一物质在不同的化学反应中可能表现出不同的克当量;另一个是这一计 算公式仅适合于化合物参加的基元反应。现举例如下:
复分解反应中生成水的克当量试看下面两个反应:
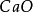 +
+ =
=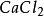 +
+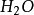 ……(1 )
……(1 )
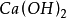 +
+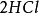 =
=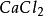 +
+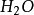 ……(2 )
……(2 )
按照上述计算化合物的克当量的公式,水的克当量应是:18/2= 9克/克当量。这样. 在(1 )中生成1摩尔水相当于18克/9克/克当量=2克当量,从反应式中看出2克当量 CaO与2克当量HCI反应生成了 2克当量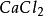 和 2克当量水,这是符合当量定律的。
和 2克当量水,这是符合当量定律的。
但在反应(2)中,如果亦按上述公式来计算生成水的克当量,就会得出2克当量的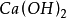 与2克当量HCl生成4克当量
与2克当量HCl生成4克当量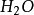 的结果,这显然违反了当量定律,当然是不 可能的。实际上,在反应(2 )中
的结果,这显然违反了当量定律,当然是不 可能的。实际上,在反应(2 )中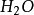 是由一个
是由一个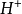 和一个
和一个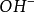 结合而成的,应把它按一价 化合物
结合而成的,应把它按一价 化合物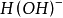 对待,即在
对待,即在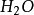 分子中,正价总数和负价总数都是一,这样水的克当量 就应该是18克/克当量,生成水的克当量数就不是4而是2 了。
分子中,正价总数和负价总数都是一,这样水的克当量 就应该是18克/克当量,生成水的克当量数就不是4而是2 了。
在生成酸式盐的反应中酸的克当量请看下面这个反应:
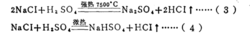
可以看出,在反应(3)中,1摩尔H2SO4相当于2克当量H2SO4,而在反应(4)屮,1摩尔H2SO4相当于1克当量H2SO4,这是因为在未加热的条件下,.生成HCI的溶解度很 大,在水中电离出的H+浓度很髙,足以抑制H2SO4的二级电离,使其只停留在一级电离阶 段。故在反应(4)中硫酸的克当量不再是49克/克当量,而是98克/克当量。这样,反应 (4 )仍然是符合当量定律的。
同理,当碱与其它物质反应生成碱式盐的时候,碱的克当量也是这样计算的。
多歩反应中化合物的克当量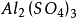 +
+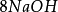 =
=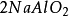 +
+ 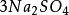 +
+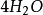
如果用计算化合物的克当量的公式直接用于这一反应,就会得出6克当量Al2( S04)3与8 克当量NaOH完全反应的结论。这当然是违背当量定律的,这是因为这一反应方程式所表示 的是一个总反应式,而总反应式只能表明反应的始态物质与终态物质之间的计量关系,而不能反映出反应所经历的真实过程。若按反应机理把上述反应分解成连续的基元反应,则各个 基元反应都是符合当量定律的。
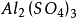 +
+ =
=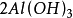 ↓ +
↓ + (i)
(i)
 =
=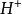 +
+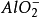 +
+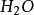 (ii)
(ii)
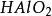 +
+ =
=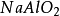 +
+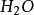 (iii)
(iii)
第(ii )步反应是Al(OH)3两性性质所决定的。由于在碱性环境中,Al(OH)3电 离、脱水、由三元碱转化为一元酸,所以它的克当量也随着改变。
氧化还原反应物质的克当量氧化还原反应昀特点是反应机理复杂,付反应多,反应速度慢,.而且随着反应条件(温度、浓度、催化剂、介质的性质、反应物填加次序等)的改变, 反应方式和产物也随着改变,所以在氧化还原反应中.某一氧化剂(或还原剂)的氧化还原当量是经常改变着的,所以更应特别注意。
物质氧化还原当量E的计算公式是:
E=物质的摩尔质量/n
式中n是该物质在反应中得失电子数或氧化数的改变值。
在氧化还原反应中,氧化剂和还原剂在基元反应中也是符合当量定律的,例如反应
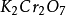 +
+  +
+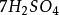 =
= +
+ +
+ +
+
其中氧化剂K2Cr2O7在反应中得到6个电子n=6,因此EK2Cr2O7= 294.18/6=49.03
还原剂FeSO4在反应中失去一个电子,所以E =151.85/1=151.85
=151.85/1=151.85
生成物 的氧化还原当量应当这样来考虑:因为一分子
的氧化还原当量应当这样来考虑:因为一分子 有二个
有二个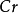 原子,而这二个
原子,而这二个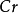 原子是从
原子是从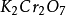 中的二个Cr原子得到6个电子转变而来的。所以n= 6
中的二个Cr原子得到6个电子转变而来的。所以n= 6
E =391.90/6=65.31
=391.90/6=65.31
反应方程中其它物质(介质及其产物除外)的氧化还原当量也是同样算法,不再详述.。可以看出在这一方程式中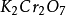 、
、 、
、 的克当量数都是6,符合当 定律。
的克当量数都是6,符合当 定律。
再举下面两个反应:
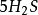 +
+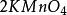 +
+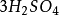 =
=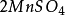 + 5S↓ +
+ 5S↓ + +
+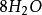 (1)
(1)
10克当量 10克当量 10克当量 10克当量
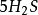 +
+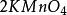 +
+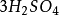 =
=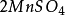 + S↓ +
+ S↓ + +
+ 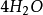 (2)
(2)
10克当量 10克当量 10克当量 2克当量 8克当量
这两个反应的反应物和生成物都相同,只是所配系数不同。可以看出,在反应(1 ) 中,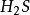 ,
, ,S的当量都数是10,.这是符合当量定律的。2
,S的当量都数是10,.这是符合当量定律的。2
本词条内容贡献者为:
张磊 - 副教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国