光学相干层析成像(optical coherence tomography, OCT)是20世纪90年代逐步发展而成的一种新的三维层析成像技术。OCT基于低相干干涉原理获得深度方向的层析能力,通过扫描可以重构出生物组织或材料内部结构的二维或三维图像,其信号对比度源于生物组织或材料内部光学反射(散射)特性的空间变化。该成像模式的核心部件包括宽带光源、迈克尔逊干涉仪和光电探测器,其轴向分辨率取决于宽带光源的相干长度,一般可以达到1-10μm,而径向分辨率与普通光学显微镜类似,决定于样品内部聚焦光斑的尺寸,一般也在微米量级。OCT具有非接触、非侵入、成像速度快(实时动态成像)、探测灵敏度高等优点。目前,OCT技术已经在临床诊疗与科学研究中获得了广泛的应用。
理论1.时域光学相干层析成像术(time domain optical coherence tomography,TDOCT)
由于纵向采用时间/空间逐点扫描的机制,成像速度受限,一般认为TDOCT属于OCT的第一代技术。如图2所示,TDOCT一般以迈克尔逊干涉仪为主体,利用单点探测器记录宽带光源(如超发光二极管)低相干干涉的时域信号。当且仅当参考臂与样品臂的光程完全匹配的情况下,才能产生干涉信号。通过参考臂的扫描,实现样品内部纵向信息(深度方向)的逐点获取。由于该扫描机制的限制,TDOCT的轴向线扫描速度(A-line)一般被限制在2-4kHz,极大的限制了TDOCT的成像速度。但是,由于其灵敏度不随深度增加而衰减,目前,TDOCT仍然用于眼前节、冠状动脉等需要较大量程的情况。
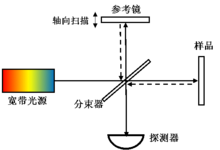
图2. 时域光学相干层析成像(TDOCT)系统示意图
2.傅里叶域光学相干层析成像术(Fourier domain optical coherence tomography,FDOCT)
由于纵向改用傅里叶域并行探测的机制,成像速度获得了极大的提升,FDOCT一般认为是OCT的第二代技术。FDOCT通过记录低相干干涉的光谱信号,利用傅里叶分析,实现纵向的空间结构信息的并行获取。目前,根据干涉光谱信号的获取方式的不同,FDOCT大致有两种实现方法:光谱域OCT和扫频OCT。
2.1 光谱域光学相干层析成像术(Spectral domain optical coherence tomography,SDOCT)
如图3所示,SDOCT一般以迈克尔逊干涉仪为主体,利用线阵相机同时记录宽带光源(如超发光二极管)的低相干干涉光谱信号,通过傅里叶变换,实现样品内部纵向信息(深度方向)的并行获取。该技术不需要参考臂的机械扫描,A-line速度主要决定于相机的曝光频率,一般可以达到几十kHz,甚至数百kHz,是目前临床眼科应用的主流技术。
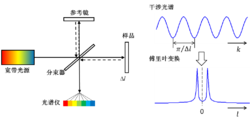
图3 光谱域光学相干层析成像(SDOCT)系统示意图
2.2 扫频光学相干层析成像技术(Swept source optical coherence tomography,SSOCT)
如图4所示,SSOCT一般以迈克尔逊干涉仪为主体,利用点探测器分时记录宽带扫频光源的低相干干涉光谱信号,通过傅里叶变换,实现样品内部纵向信息(深度方向)的并行获取。该技术的成像速度主要决定于光源的扫频频率。得益于高速扫频光源技术的发展,该OCT技术目前最高可以实现数MHz的纵向线扫描速度,具有良好的发展前景。
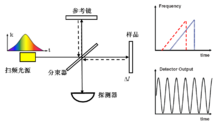
图4 扫频光学相干层析成像(SSOCT)系统示意图
功能拓展应用普通OCT技术可以实现组织内部微观形态结构的三维活体成像,通过与Doppler技术、光谱技术、偏振技术等结合,可以获得三维空间分辨的生物组织生理功能信息。特别是,通过将OCT与动态散射技术结合可以实现无标记三维微血管造影,获得组织内部血流灌注的三维活体成像。
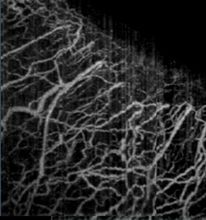
图5. 人眼角巩膜缘处微血管造影[2]
在临床眼科中,OCT可以实现眼前节(角膜、房角、晶状体等)、视网膜和脉络膜等重要眼组织的活体三维成像,可用于糖尿病性视网膜病变、老年性黄斑变性和青光眼等疾病的诊断和治疗。OCT还可以用于冠状动脉、消化道、呼吸道、脑皮层、癌症、皮肤等生物组织的成像,以及某些材料特性的检测。
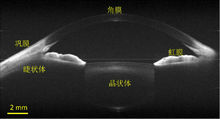
图6. 人眼活体全眼前节大视场OCT断层成像[3]
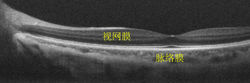
图7. 人眼活体眼底大视场OCT断层成像[4]
扩展阅读1. P. Li, Z. Ding, Y. Ni, B. Xu, C. Zhao, Y. Shen, C. Du, and B. Jiang, "Visualization of the ocular pulse in the anterior chamber of the mouse eye in vivo using phase-sensitive optical coherence tomography," Journal of Biomedical Optics 19, 090502-090502 (2014).
2. P. Li, L. An, R. Reif, T. T. Shen, M. Johnstone, and R. K. Wang, "In vivo microstructural and microvascular imaging of the human corneo-scleral limbus using optical coherence tomography," Biomed. Opt. Express 2, 3109-3118 (2011).
3. P. Li, L. An, G. Lan, M. Johnstone, D. Malchow, and R. K. Wang, "Extended imaging depth to 12mm for 1050-nm spectral domain optical coherence tomography for imaging the whole anterior segment of the human eye at 120-kHz A-scan rate," Journal of Biomedical Optics 18, 016012-016012 (2013).
4. L. An, P. Li, G. Lan, D. Malchow, and R. K. Wang, "High-resolution 1050 nm spectral domain retinal optical coherence tomography at 120kHz A-scan rate with 6.1 mm imaging depth," Biomed. Opt. Express 4, 245-259 (2013).
5. D. Huang, E. Swanson, C. Lin, et al., Optical coherence tomography. Science, 1991, 254: 1178-1181.
6. M. Choma, M. Sarunic, C. Yang, et al., Sensitivity advantage of swept source and Fourier domain optical coherence tomography. Opt. Express, 2003, 11(18): 2183-2189.
7. J. G. Fujimoto, M. E. Brezinski, G. J. Tearney, et al., Optical biopsy and imaging using optical coherence tomography. Nat. Med., 1995, 1: 970-972.
8. J. S. Schuman, C. A. Puliafito, J. G. Fujimoto, Optical Coherence Tomography of Ocular Diseases, 2nd edn. Slack Inc., Thorofare, NJ, 2004.
9. S. Kray, F. Spoler, M. Forst, et al., Dual femtosecond laser multiheterodyne optical coherence tomography. Opt. Lett., 2008, 33: 2092-2094.
10. R. Leitgeb, W. Drexler, A. Unterhuber, et al., Ultrahigh resolution Fourier domain optical coherence tomography. Opt. Express, 2004, 12(10): 2156-2165.
11. Y. Chen, A. D. Aguirre, P. L. Hsiung, et al., optical coherence tomography of Barrett's esophagus: preliminary descriptive clinical study correlating images with histology. Endoscopy, 2007, 39: 599-605.
12. T. Ko, D. Adler, J. Fujimoto, et al., Ultrahigh resolution optical coherence tomography imaging with a broadband superluminescent diode light source. Opt. Express, 2004, 12(10): 2112-2119.
13. B. Bouma, G. J. Tearney, S. A. Boppart, et al., High-resolution optical coherence tomographic imaging using a mode-locked Ti:Al2O3 laser source. Opt. Lett., 1995, 20(13): 1486-1488.
14. W. Drexler, U. Morgner, R. K. Ghanta, et al., Ultrahigh-resolution ophthalmic optical coherence tomography.Nat. Med., 2001, 7: 502-507.
15. T. H. Ko, J. G. Fujimoto, J. S. Duker, et al., Comparison of ultrahigh- and standard-resolution optical coherence tomography for imaging macular hole pathology and repair. Ophthalmology, 2004, 111: 2033-2043.
16. A. F. Fercher, C. K. Hitzenberger, G. Kamp, et al., Measurement of intraocular distances by backscattering spectral interferometry. Opt. Commun., 1995, 117: 43-48.
17. R. Leitgeb, C. Hitzenberger, and A. Fercher, Performance of fourier domain vs. time domain optical coherence tomography. Opt. Express, 2003, 11(8): 889-894.
18. J. F. de Boer, B. Cense, B. H. Park, et al., Improved signal-to-noise ratio in spectral-domain compared with time-domain optical coherence tomography. Opt. Lett., 2003, 28(21): 2067-2069.
19. M. Wojtkowski, R. Leitgeb, A. Kowalczyk, et al., In vivo human retinal imaging by Fourier domain optical coherence tomography. J. Biomed. Opt., 2002, 7: 7457-7463.
20. N. Nassif, B. Cense, B. Park, et al., In vivo high-resolution video-rate spectral-domain optical coherence tomography of the human retina and optic nerve. Opt. Express, 2004, 12: 367-376.
21. S. R. Chinn, E. A. Swanson, and J. G. Fujimoto, Optical coherence tomography using a frequency-tunable optical source. Opt. Lett., 1997, 22(5): 340-342.
22. S. Yun, G. Tearney, J. de Boer, et al., High-speed optical frequency-domain imaging. Opt. Express, 2003, 11(22): 2953-2963.
23. S. H. Yun, G. J. Tearney, B. J. Vakoc, et al., Comprehensive volumetric optical microscopy. Nat. Med., 2006, 12: 1429-1433.
24. D. C. Adler, Y. Chen, R. Huber, et al., Three-dimensional endomicroscopy using optical coherence tomography. Nat. Photonics, 2007, 1: 709-716.
25. Y. Zhao, Z. Chen, C. Saxer, et al., Phase-resolved optical coherence tomography and optical Doppler tomography for imaging blood flow in human skin with fast scanning speed and high velocity sensitivity. Opt. Lett., 2000, 25: 114-116.
26. R. K. Wang, S. L. Jacques, Z. Ma, et al., Three dimensional optical angiography. Opt. Express, 2007, 15: 4083-4097.
27. Z. Chen, Y. Zhao, and S. Srinivas, Doppler Optical Coherence Tomography. IEEE J. Sel. Topics Quant. Electron., 1999, 5: 1134-1142.
28. C. L. Evans, E. O. Potma, and X. S. Xie, Coherent anti-Stokes Raman scattering spectral interferometry: determination of the real and imaginary components of nonlinear susceptibility X for vibrational microscopy. Opt. Lett., 2004, 29(24): 2923-2925.
29. Wang C, Ding Z, Mei S, et al. Ultralong-range phase imaging with orthogonal dispersive spectral-domain optical coherence tomography[J]. Opt. Lett., 2012, 37(21): 4555-4557.
30. Bao W, Ding Z, Li P, et al. Orthogonal dispersive spectral-domain optical coherence tomography[J]. Opt. Express, 2014, 22(8): 10081-10090.
徐可欣, 高峰, 赵会娟. 生物医学光子学. 科学出版社. 2011年7月, 第2版.
张镇西. 生物医学光子学新技术及应用. 科学出版社. 2008年5月, 第1版
王凯. 谱域光学相干层析成像方法与系统研究[D].浙江大学, 2010.
孟婕. 多普勒光学相干层析成像方法与应用研究[D].浙江大学, 2010.




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国