超分辨光学成像特指分辨率打破了光学显微镜分辨率极限(200nm)的显微镜,技术原理主要有受激发射损耗显微镜技术和光激活定位显微镜技术。
简介光学显微镜凭借其非接触、无损伤等优点,长期以来是生物医学研究的重要工具。但是,自1873年以来,人们一直认为,光学显微镜的分辨率极限约为200 nm,无法用于清晰观察尺寸在200 nm以内的生物结构。超分辨光学成像(Super-resolution Optical Microscopy)是本世纪光学显微成像领域最重大的突破,打破了光学显微镜的分辨率极限(换言之,超越了光学显微镜的分辨率极限,故被称为超分辨光学成像),为生命科学研究提供了前所未有的工具。
光学显微镜的分辨率1873年,德国物理学家恩斯特·阿贝(Ernst Abbe)提出,光学显微镜受限于光的衍射效应和光学系统的有限孔径,存在分辨率极限(也称阿贝极限),其数值约为l / 2NA(分辨率极限公式),其中l是光波波长,NA是光学系统的数值孔径(Numerical Aperture)。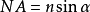 , n为介质的折射率,a为物镜孔径角的一半。成像时若使用波长为400 nm的光,并采用空气(折射率为1)作为物镜和样本之间的介质,可计算得到分辨率极限为200 nm。因此,我们通常说,光学显微镜的分辨率极限约为200 nm。
, n为介质的折射率,a为物镜孔径角的一半。成像时若使用波长为400 nm的光,并采用空气(折射率为1)作为物镜和样本之间的介质,可计算得到分辨率极限为200 nm。因此,我们通常说,光学显微镜的分辨率极限约为200 nm。
此后的研究表明,光学显微镜的分辨率决定于光学系统中聚焦光斑(称为艾里斑, Airy disc)的尺寸。另外,当一个艾里斑的边缘与另一个艾里斑的中心正好重合时,此时对应的两个物点刚好能被人眼或光学仪器所分辨(这个判据称为瑞利判据,Rayleigh Criterion)。利用瑞利判据以及艾里斑的数学表达式,我们可以得到光学显微镜的分辨率公式:0.61λ/NA。值得指出的是,光学显微镜的分辨率公式跟前面提到的分辨率极限公式有所不同,而前者更广泛的被光学成像领域使用。
提高光学显微镜分辨率的途径为了提高光学显微镜的分辨率,早期的工作往往集中在如何减小艾里斑的尺寸,包括减小光的波长、增大数值孔径。对于前者,直接导致了各种电子显微镜的诞生---采用波长为纳米甚至亚纳米级的电子束进行成像,其分辨率可达纳米量级甚至更小。对于后者,一方面可以更高折射率的成像介质,例如,将空气换为水(折射率为1.333),采用400 nm的光进行成像,极限分辨率可高达150 nm。另一方面,可以利用结构更为复杂的光学收集系统(如共轭双物镜)来增加光学显微镜的有效孔径角,从而提高光学显微镜相对较差的轴向分辨率,其典型代表为4Pi显微镜。此外,还可以使用共焦小孔等来限制艾里斑的尺寸并消除杂散光,从而提高光学显微镜的横向和纵向分辨率,其典型代表是共聚焦显微镜(Confocal Microscope)。
值得指出的是,这里所述的光学显微镜指的是远场光学显微镜(Far-field Optical Microscope),物镜和样本之间的距离远大于光的波长。进一步的研究表明,远场光学显微镜存在分辨率极限的主要原因在于远场一般只能收集传导波信号,而携带了高频信息的倏逝波(Evanescent Wave),其电场强度随传播距离的增加而呈指数衰减。因此,若使用距样本表面仅几个纳米的探针收集并探测近场光信号,可以大幅提高光学显微镜的分辨率,这种思路导致了近场扫描光学显微镜(Near-field Scanning Optical Microscope, NSOM)的诞生,其分辨率可以优于25 nm。而基于倏逝场扫描成像的光学显微镜,通常被称为近场光学显微镜(Near-field Optical Microscope)。
超分辨光学成像技术超分辨光学成像技术通常指的是基于远场光学显微镜的超分辨成像技术,主要包括两种实现途径:一种是基于特殊强度分布照明光场的超分辨成像方法(如STED)。另一种是基于单分子成像和定位的方法(如PALM)。
1.受激发射损耗显微镜技术(Stimulated Emission Depletion Microscopy, 简称STED)
该成像理论来源于爱因斯坦的受激辐射理论,德国科学家斯蒂芬·赫尔(Stefan W. Hell)创造性地利用受激辐射来抑制自发荧光辐射,最终实现了受激发射损耗显微镜技术(STED)。一个典型的STED显微镜需要两束严格共轴的激光,其中一束为激发光,另外一束为损耗光(也称STED光)。利用激发光使艾里斑范围内的荧光分子被激发,其电子从基态跃迁到激发态。随后,使用甜甜圈型(Doughnut,跟救生圈形状类似)的损耗光照射样品,使得处于激发光斑外围的激发态分子以受激辐射的方式释放能量回到基态,而位于激发光斑内部区域的激发态分子则不受损耗光的影响,继续以自发荧光的方式回到基态。这种照明方式的组合,将荧光发射区域限制在小于艾里斑的区域内,获得了一个小于衍射极限的荧光发光点。最后,通过在二维(或三维)空间内扫描共轴的激发光和损耗光,获得一幅二维(或三维)超分辨图像。1994年,斯蒂芬·赫尔等人提出了STED显微镜的理论。2000年,斯蒂芬·赫尔研究组通过生物实验证实了STED显微镜的超分辨成像能力。
2.光激活定位显微镜技术(Photoactivation Localization Microscopy, 简称PALM)
阿贝极限指出,在远场无法分辨相距l / 2NA的两个荧光分子所成的像,但是并没有对单个荧光分子的中心位置确定精度进行限制。如果在艾里斑内仅有一个分子在发射荧光, 我们可以利用单分子定位算法并结合光学系统艾里斑的形状,以超高精度(纳米量级)获得荧光分子的中心位置。倘若将这个单分子定位思想用于实现超分辨成像,其关键在于如何在一个艾里斑内区分多个荧光分子。
为了克服一个艾里斑内只允许一个分子发射荧光的限制,1995年美国科学家埃里克·白兹格(Eric Betzig)通过理论分析,提出可以利用光谱特性对艾里斑内的发射波长不同的荧光分子进行分时探测和中心位置定位,从而实现荧光密集标记样本的超分辨成像。2006年, 埃里克·白兹格等人利用光激活绿色荧光蛋白(PA-GFP)的可控荧光开关特性,结合单分子定位算法,实现了生物样本的超分辨成像。他们首先利用低能量的 405 nm 激光(激活光)来稀疏活化PA-GFP,再使用 561 nm激光(激发光)对活化后的PA-GFP进行单分子荧光成像,直至活化后的PA-GFP分子被光漂白。重复激活-激发-定位-漂白过程,可以在艾里斑内高精度找到大量PA-GFP分子的中心位置,从而重建出一幅由PA-GFP分子中心位置组成的超分辨图像。这种技术被称为光激活定位显微镜(Photoactivation Localization Microscopy, 简称PALM)。
2006年,哈佛大学的庄小威小组提出了随机光学重建显微镜(Stochastic Optical Reconstruction Microscopy,简称STORM),其成像原理与 PALM 类似,但是在密集标记样本内实现荧光发射稀疏化的方案有所不同。
2014年诺贝尔化学奖2014年10月8日,瑞典皇家科学院宣布,将2014年诺贝尔化学奖授予美国霍华德·休斯医学研究所的埃里克·白兹格(Eric Betzig),德国马克斯·普朗克生物物理化学研究所的斯蒂芬·赫尔(Stefan W. Hell),美国斯坦福大学的威廉·莫尔纳(William E. Moerner),以表彰他们在超分辨荧光成像技术领域取得的成绩。
本词条内容贡献者为:
黄振立 - 教授 - 华中科技大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国