在燃烧的研究中,根据过程如何完成,恒定的体积和恒定的压力,存在两种类型的绝热火焰温度,描述在没有能量损失到外部环境的情况下燃烧产物理论上达到的温度。
在恒定体积绝热火焰温度是温度,从一个完整的结果燃烧时发生,没有任何处理的工作,热传递或改变动能或势能。它的温度低于定容量过程,因为一些能量被用来改变系统的体积(即产生功)。
共同的火焰在日常生活中,遇到的绝大多数火焰是有机化合物,包括木材,蜡,脂肪,普通塑料,丙烷和汽油。这些物质在空气中的恒压绝热火焰温度在1950℃附近处于相对较窄的范围内。这是因为,在以下方面的化学计量,有机化合物的与燃烧n碳涉及断裂大致2nC–H键,nC–C键和1.5nO2键以形成大致nCO2分子和nH2O分子。
由于大多数自然发生的燃烧过程发生在露天,所以没有任何东西将气体限制在发动机中的气缸之类的特定容积内。结果,这些物质将在恒定的压力下燃烧,使气体在该过程中膨胀。
 假定初始大气条件(1巴和20℃),下表列出了恒压条件下各种气体的绝热火焰温度。这里所说的温度是用于化学计量的燃料-氧化剂混合物(即当量比φ= 1)。
假定初始大气条件(1巴和20℃),下表列出了恒压条件下各种气体的绝热火焰温度。这里所说的温度是用于化学计量的燃料-氧化剂混合物(即当量比φ= 1)。
请注意,这些是火焰产生的理论而非实际的火焰温度,不会产生热量。最接近的将是火焰中最热的部分,其中燃烧反应是最有效的。这也假定完全燃烧(例如完全平衡的,无烟的,通常是蓝色的火焰)
普通燃料的绝热火焰温度(恒定压力)汽油氧化剂{\ displaystyle T_ {ad}}(C){\ displaystyle T_ {ad}}(F)| 乙炔(C2H2) | 空气 | 2500 | 4532 |
| 乙炔(C2H2) | 氧 | 3480 | 6296 |
| 丁烷(C4H10) | 空气 | 1970年 | 3578 |
| 氰基(C2N2) | 氧 | 4525 | 8177 |
| 二氰乙炔(C4N2) | 氧 | 4990 | 9010 |
| 乙烷(C2H6) | 空气 | 1955年 | 3551 |
| 乙醇(C 2H 5OH) | 空气 | 2082 | 3779 |
| 汽油 | 空气 | 2138 | 3880 |
| 氢(H2) | 空气 | 2254 | 4089 |
| 氢(H2) | 氧 | 3200 | 5792 |
| 镁(Mg) | 空气 | 1982年 | 3600 |
| 甲烷(CH4) | 空气 | 1963年 | 3565 |
| 甲醇(CH4O) | 空气 | 1949年 | 3540 |
| 天然气 | 空气 | 1960年 | 3562 |
| 戊烷(C5H12) | 空气 | 1977年 | 3591 |
| 丙烷(C3H8) | 空气 | 1980年 | 3596 |
| 丙烷(C3H8) | 氧 | 2526 | 4579 |
| MAPP气体甲基乙炔(C3H4) | 空气 | 2010 | 3650 |
| MAPP气体甲基乙炔(C3H4) | 氧 | 2927 | 5301 |
| 甲苯(C7H8) | 空气 | 2071 | 3760 |
| 木 | 空气 | 1980年 | 3596 |
| 煤油 | 空气 | 2093 | 3801 |
| 轻油燃料 | 空气 | 2104 | 3820 |
| 中等燃料油 | 空气 | 2101 | 3815 |
| 重燃料油 | 空气 | 2102 | 3817 |
| 烟煤 | 空气 | 2172 | 3943 |
| 无烟煤 | 空气 | 2180 | 3957 |
| 无烟煤 | 氧 | ≈2900 | ≈5255 |
| 铝 | 氧 | 3732 | 6750 |
| 锂 | 氧 | 2438 | 4420 |
| 磷(白) | 氧 | 2969 | 5376 |
| 锆 | 氧 | 4005 | 7241 |
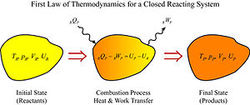 从热力学的第一定律来看,我们有一个封闭的反应系统,
从热力学的第一定律来看,我们有一个封闭的反应系统,
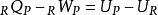 其中,
其中,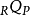 和
和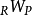 是分别在这个过程中从系统转移到周围环境的热量和功
是分别在这个过程中从系统转移到周围环境的热量和功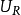 和
和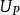 分别是反应物和产物的内能。在恒定绝热火焰温度的情况下,系统的体积保持不变,因此没有工作发生,
分别是反应物和产物的内能。在恒定绝热火焰温度的情况下,系统的体积保持不变,因此没有工作发生,
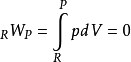
并且没有传热,因为该过程被定义为绝热的: 。结果,产物的内能等于反应物的内能:
。结果,产物的内能等于反应物的内能: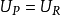 。因为这是一个封闭的体系,所以产品和反应物的质量是不变的,第一定律可以写成大规模的,
。因为这是一个封闭的体系,所以产品和反应物的质量是不变的,第一定律可以写成大规模的,
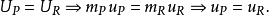
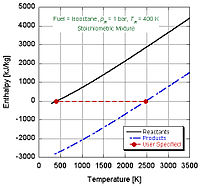
在恒压绝热火焰温度的情况下,系统的压力保持不变,导致下面的工作方程,
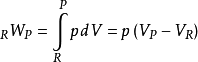
再次没有传热发生,因为该过程被定义为绝热的: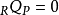 。从第一条法则来看,我们发现1,
。从第一条法则来看,我们发现1,
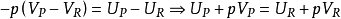
回顾我们恢复的焓的定义: 。因为这是一个封闭的体系,所以产品和反应物的质量是不变的,第一定律可以写成大规模的,
。因为这是一个封闭的体系,所以产品和反应物的质量是不变的,第一定律可以写成大规模的,
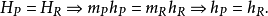
我们看到恒压过程的绝热火焰温度低于恒定过程的绝热火焰温度。这是因为在燃烧过程中释放的一些能量会改变控制系统的体积。通常在两个过程之间进行的一个类比是通过在内燃机中燃烧。对于恒定体积绝热过程,当活塞到达其顶点(Otto循环或恒定容积循环)时,燃烧被认为是瞬间发生的。对于恒压绝热过程,当发生燃烧时,活塞正在移动以保持压力恒定(柴油循环或恒定压力循环)。
如果我们假设燃烧完成(即,{\ displaystyle CO_ {2}}和{\ displaystyle H_ {2} O}),我们可以在化学计量条件下或者在稀化学计量(多余空气)下手工计算绝热火焰温度。这是因为有足够的变量和摩尔方程来平衡左侧和右侧,
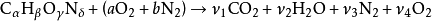
化学计量比较多,没有足够的变量,因为至少燃烧不能完成{\ displaystyle CO}和{\ displaystyle H_ {2}}需要的摩尔平衡(这些是最常见的不完全燃烧产物),
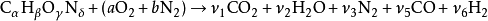
但是,如果我们包括水煤气变换反应,
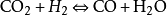
并使用这个反应的平衡常数,我们将有足够的变量来完成计算。
具有不同能量和摩尔组分的不同燃料将具有不同的绝热火焰温度。
我们可以看到为什么硝基甲烷(CH3NO2)经常被用作汽车的动力提升。由于每摩尔硝基甲烷含有两摩尔氧气,因此它可以燃烧得更热,因为它提供了自己的氧化剂和燃料。这反过来又使其在恒定量的过程中产生更多的压力。压力越高,活塞上的力越大,在发动机中产生更多的功和更多的功率。值得注意的是,由于它含有自己的氧化剂,所以它保持比较热的化学计量比。然而,由于这个较高的温度,在硝基甲烷上连续运行发动机将最终熔化活塞和/或汽缸2。
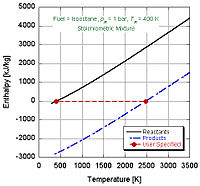
在现实世界的应用中,完全燃烧通常不会发生。化学规定解离和动力学会改变产物的相对组分。有许多方案可以计算绝热火焰的温度,考虑到通过平衡常数解析(Stanjan,NASA CEA,AFTP)。下图说明了解离的影响会降低绝热火焰的温度。这个结果可以通过Le Chatelier的原理来解释。
由于火焰温度对化学反应速率所起到的作用,火焰温度可能是燃烧最重要的一个性质。火焰温度既可以通过实验测量出来,又可以通过计算得到。为了方便起见,引入了绝热火焰温度的概念。绝热火焰温度指的是,在一定的初始温度和压力下,给定的燃料(包含燃料和氧化剂),在等压绝热条件下进行化学反应,燃烧系统(属于封闭系统)所达到的终态温度。在实际中,火焰的热量有一部分以热辐射和对流的方式损失掉了,所以绝热火焰温度基本上不可能达到。然而,绝热火焰温度在燃烧效率和热量传递的计算中起到很重要的作用。对于高温火焰(高于1800 K ),燃烧产物发生了分解反应,不但体积增大,还吸收了大量的热量。在低温时,化学当量比混合物或者贫燃料混合物燃烧后的产生应该只有CO2和H2O,然而这些产物很不稳定,只要温度稍高一点,就可能部分转变为成简单的分子、原子和离子形式(例如,C0, H2, O, H和OH)。相应地在转变过程中,能量被吸收,最大火焰温度也相应地被减小了。
绝热火焰温度的影响因素很多,主要有空气/燃料比、初始温度和初始压力3。




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国