概念
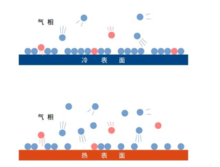 当有多种气体分子同时存在(比如示意图中的红色和蓝色的小球)时,它们就会相互竞争。动力学方程的框架相同,只不过每种分子的脱附速率都只和其在表面的覆盖率成正比。但吸附速率却和空位成正比。比如:
当有多种气体分子同时存在(比如示意图中的红色和蓝色的小球)时,它们就会相互竞争。动力学方程的框架相同,只不过每种分子的脱附速率都只和其在表面的覆盖率成正比。但吸附速率却和空位成正比。比如:
A分子在表面的相互作用比B大一些;
A分子在气相中的分压比B大。
那么显然A在竞争吸附中占优势,在表面占有更高的覆盖率。结合力越强(即平衡常数Keq越大),覆盖率约高;分压约高,覆盖率约高。
矿物对金属离子竞争吸附研究吸附描述 矿物一水界面地球化学作用对控制元素地表循环、世界淡水质量、土壤的发展和某些金属的成矿起着关键的作用。在地表三大圈层互相作用中,岩石圈(包括上壤)与水圈之间的相互物质交换作用是通过矿物表面作用而实现,是三大圈层作用最重要的一环。这种作用包括矿物的溶解与生长、共沉淀吸附与离子交换、氧化还原等,这就是水岩相互作用。近年人们通 过调 查发现,在工业密集区附近沉 积物中重金属的积累达到可怕的程度,是正 常沉积物的几十到几百倍。这种积累严重影响着环境生态与淡水质量,正引起世界各国的关注并考虑其整治办法。同时,这种积累与富集也正是地球化学家所关注的课题,即通过矿物一水界面作用而富集成矿的问题。这两个问题都牵涉到矿物表面吸附反应。1相关研究通过矿物对金属离子竞争吸附实验来探讨其在沉积矿物各相中的分配。
矿物一水界面地球化学作用对控制元素地表循环、世界淡水质量、土壤的发展和某些金属的成矿起着关键的作用。在地表三大圈层互相作用中,岩石圈(包括上壤)与水圈之间的相互物质交换作用是通过矿物表面作用而实现,是三大圈层作用最重要的一环。这种作用包括矿物的溶解与生长、共沉淀吸附与离子交换、氧化还原等,这就是水岩相互作用。近年人们通 过调 查发现,在工业密集区附近沉 积物中重金属的积累达到可怕的程度,是正 常沉积物的几十到几百倍。这种积累严重影响着环境生态与淡水质量,正引起世界各国的关注并考虑其整治办法。同时,这种积累与富集也正是地球化学家所关注的课题,即通过矿物一水界面作用而富集成矿的问题。这两个问题都牵涉到矿物表面吸附反应。1相关研究通过矿物对金属离子竞争吸附实验来探讨其在沉积矿物各相中的分配。
仅从单位重量矿物吸附量来看,规律并不明显,似乎蒙脱石和高岭土对所有金属离子都表现出较强的吸附能力,合成针铁矿对Ni2+、 Cd2+和粉石英对Ag+都有较大的吸附量。但是考虑到吸附是一表面过程,从单位面积吸 附的离子数(Dexp)看,不同的矿物对金属离子的吸附能力差别可达103以上,它们大小顺序排列是:CaCO3> 石英>水云母 >高岭土>蒙脱石>针铁矿>三水铝矿。Freedman研究了石英、方解石、高岭土和蒙脱石等四种矿物 对地下水中重金属离子的吸附。对不同金属离子,单位重量矿物吸附能力大小排列不同。但对单位面积而言,矿物对金属离子吸附能力大小排列为:方解石>石英>高岭土>蒙脱石。例外的是,石英对Cu2+、Cr3+的吸附大于方解 石。同种矿物对不同的金属离子吸附能力差别一般不超过一个数量级。2
吸附原理一种凝聚态物质表面(或外部边界)的原子由于其表面悬键的存在,具有吸附外来离子或分子以减少其表面自由能的倾向。许多矿物,特别是氧化物矿物、硅酸盐矿物和氢氧化物矿物表面接触水时,即与水发生反应,产生氢 氧化功能团,或水解反应。这个功能团作用类似于弱的布朗斯台德(Bronsted)酸或碱,既可离解使表面带上电荷,又可与溶液的离子(或分子)反应形成表面配位配合物。
在中性条件下,高岭土中硅氧四面体表面硅氧烷表现出强的质子施主特性,因此铝氧烷则变成质子受 主。四 面体层与八面体层表面相互作用的结果是硅氧烷吸附金属离子作用微弱,其表面吸附主要靠铝氧烷。这种吸附作 用的削弱,结果是高岭土吸附反应平衡常数下降,而归入氧化物类。而通常2:1层状产物,由于层间离子交换性 与羁留性,其对阳离子吸附反应能力也相应增加。
碳酸盐矿物结构与上述两组矿物有很大的差别。其中阴离子碳酸根基团中碳一氧键很强,而金属离子与氧之间离子键较弱。当它与溶液作用时常表现出两种独立离子基团的特性。在矿物表面二者也表现出非常不同的质子化特性常数。与碳酸盐类似的矿物应包括硫酸盐和磷酸盐矿物等。含氧盐矿物的这种较高的吸附反应平衡常数特性可能与其复杂表面吸附反应机制有关。它除了形成表面配合物反应外,还有表面离子交换作用和被吸附离子向 晶格内部的扩散作用。当然,对硫酸盐和磷酸盐还需进一步研究来证实。2




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国