反应原理
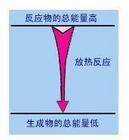 反应前总能量大于反应后总能量的化学反应叫做放热反应(exothermic reaction)1
反应前总能量大于反应后总能量的化学反应叫做放热反应(exothermic reaction)1
△H=反应物键能-生成物键能
反应类型燃烧、中和、金属氧化、铝热反应、较活泼的金属与酸反应、由不稳定物质变为稳定物质的反应多数化合反应是放热的(但是我们要注意高压下石墨转变成金刚石也是放热反应,尽管常压下是相反的),多数分解反应是吸热的(但均不能绝对化,如氯酸钾分解生成氯化钾与氧气就是常见的放热反应)能自发进行的氧化还原反应都是放热反应,常见反应中燃烧反应、中和反应全是放热反应,酸碱中和的反应,金属与酸的反应,金属与水的反应,燃烧反应,爆炸反应全是放热反应,在具体判断中往往要结合记忆中的事实来进行。 放热反应的逆反应一定是吸热反应。2
常见反应(1)所有燃烧或爆炸反应。
(2)酸碱中和反应。
(3)多数化合反应。
(4)活泼金属与水或酸生成H2的反应。
(5)很多氧化还原反应(但不能绝对化)。如氢气、木炭或者一氧化碳还原氧化铜都是典型的放热反应。
(6)NaOH或浓硫酸溶于水(注:这两点只是说会放热,但严格说起来并不算化学反应,考试时应注意)
四种基本反应类型与放热反应的关系化合反应绝大多数的化合反应是放热反应
1 氢化物的生成反应是放热反应
例如 氢气与氟气黑暗处就爆炸放热:H2 +F2 =2HF
2 氧化物的生成是放热反应
例如木炭在空气或氧气中燃烧放热:C+O2 = CO2
3含氧酸的生成反应
例如 三氧化硫溶于水生成硫酸是放热反应:SO3 +H2O=H2SO4
4强碱的生成反应是放热反应
例如氧化钠与水反应生成氢氧化钠放热:Na2O+H2O=2NaOH
分解反应分解反应少数是放热反应
例如硝酸铵受热或受到撞击爆炸发生分解反应放热:2NH4NO4 =N2 ↑+O2 ↑ +4H2O
置换反应大多数置换反应是放热反应
1 活泼金属与水发生置换反应放热的实例
钠与水发生置换反应时放热:2Na+2H2O=2NaOH+H2 ↑
2 活泼非金属与水发生置换反应放热的实例
氯气与水发生岐化反应时放热:Cl2+H2O=HCl+HClO
3 单质铝与某些金属氧化物发生的铝热反应放热的实例
在高温条件下铝粉与二氧化锰发生置换反应时放热:4Al+3MnO 2=2Al2O3 + 3Mn
4活泼金属与酸发生的置换反应放热的实例
金属钠与盐酸发生置换反应时放热:2Na+2HCl=2NaCl+H2 ↑
复分解反应酸碱中和反应是放热反应
盐酸和氢氧化钠溶液反应是放热反应:HCl+NaOH=NaCl+H2O
如何区分化学反应的本质是:旧键的断裂和新键的形成,而新形成的化学键一般比旧键要稳定,共价电子从高能级向低能级跃迁,释放能量,而旧键的断裂则需要吸收能量,所以最终化学反应是吸热还是放热看的是反应前后能量变化差值,如果能量不足,则需要从外界吸热,反之放热,通常我们用焓变(△H)来衡量反应前后的热现象.3




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国