简介
吹炼(converting)鼓风将液态氧化除去铜锍中的铁和硫,产出粗金属或金属富集物的火法冶金过程。铜的吹炼过程一般分为两周期,第一周期是FeS的氧化造渣产出白铜铣(Cu2S),第二周期是Cu2S的氧化得到粗铜。一般称第一周期为造渣期,第二周期为造铜期。镍硫的吹炼只有第一周期,产出高镍硫(Ni3S2),不继续吹炼得粗镍而另行处理。
吹炼作业是火法炼铜工序中不可缺少的作业,将空气鼓入铜锍熔体并与铜锍熔体中的铁、硫进行氧化反应放出热量,维持自热吹炼,经过造渣期和造铜期操作,生成粗铜。
在造铜期,随着Cu2S的氧化,炉内熔体的体积逐渐减小,到造铜期终点出铜。出铜后迅速捅风眼,清除结块。然后装入铜锍,开始下一炉次的吹炼。
造铜期物化反应白冰铜氧化过程中的相变按反应:Cu2S+O2(g)═ 2Cu(l)+SO2(g) (脱硫过程)
在吹炼中可取温度1200℃,由于熔体Cu2S脱硫至19.80%(重量)即开始分层,直至含硫量为1.2%左右,才开始转变为低硫单相熔体。因此在白冰铜吹炼期,长时间是在分层期进行氧化作业的。转炉中的PSO2取0.1atm,平衡PO2=0.7atm。故
K = PSO2/PO2=106
反应平衡常数很大。因此,反应可用下列示意图表示。
Cu2S+O2→ (Cu2S,SO2,Cu)→ (SO2,Cu)
再从Cu-S系及Cu-O系相图可以看出,当熔体含硫量等于20.14%(Cu2S化学计量成分),整个熔体为均匀的单相熔体。随着氧化反应的进行,熔体的含硫量不断降低,至图中B点时开始分层。二液相共存,一层以Cu2S为主含有饱和金属铜;另一层则以金属铜为主含有饱和的硫,由于比重差的关系铜熔体在下部。继续吹风,含硫量继续减少,如图中BC线段。至C点时熔体由二液相转变为单相熔体,此时含硫量约在1.2%左右,单独的Cu2S层已消失而代之以金属铜,只含有少量的硫。视氧化程度和温度条件,铜液中同时含少量硫和氧。图中C-e线即为铜中含硫量与温度的关系。继续吹风,铜中含硫量还可降低,但含氧量则相应增多。在生产上为避免过吹,要严格控制脱硫的程度,一般含硫量在0.5%左右,即需停止吹风,从图中还可看出,如吹炼控制不好,过吹的结果将使铜转变为Cu+Cu2O,固溶体,至D点时,Cu2O开始析出并分层,吹炼将告失败。1
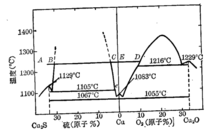
转炉富氧氧化在粗铜生产期共存有炉气一白冰铜一金属钢三相,其组分共有 Cu,S及O。因此,按相律决定体系状态变数只有两个,即温度与气相中的分压(PO2或PSO2)。
从Cu-S系相平衡图可以看出,白冰铜在吹炼期,脱硫反应在很大的范围内处于分层区进行。这一段含硫量由19.80%降至1.2%(1200℃)。因此,讨论强化过程在分层区具有重要实际意义。
按Cu2S-Cu系分层区的硫势与温度的关系:
log(Ps2)= -15505/T + 4.56
二氧化硫离解的硫势和氧势关系:
log(Ps21/2)= -18940/T+3.87 - log(PO2)+ log(PSO2)
又按吹炼生产作业的气体组成见下表所示。
|| ||
表中示出二周期SO2+SO3平均达18%左右,自由氧波动在1.3×103—4.2×103atm。指定二周期平均温度为1200℃,SO2=18%。1
造铜期的反应动力学造铜期的主要反应为白冰铜(Cu2S)的氧化,反应速率与熔体中的含硫量和供氧速度均有一定的关系。Cu2S的氧化产物会有不同的存在形态,因而使白冰铜的氧化过程变得复杂。在1193℃的温度下用O2—Ar混合气体(10%O2,90%Ar)氧化Cu2S熔体时,熔体的质量变化ΔW与反应时间t的关系如下图所示。由图可见,Cu2S的氧化过程可以分成两个不同的阶段:第一阶段为Cu2S的脱硫反应,熔体的质量随反应的进行而减小;第二阶段为Cu的氧化反应,熔体的质量随反应的进行而增大。2
这种现象可以用Cu-S系和Cu-O系相图进行说明。从下图可以看出,当熔体含硫量等于33.3%(原子百分数)时,熔体完全由Cu2S组成,体系处于均匀的单相区,如图中a点所示。随着氧化反应的进行,熔体含硫量开始下降,并有少量的金属铜生成,但生成的金属铜能够完全溶解在白冰铜中,熔体仍处于单相区,此时,反应速率与熔体含硫量成正比,如图中曲线a-b段所示,故
-dΔW/dt= k1Csn
式中,k1为表观速率常数;Cs为熔锍的含硫量,n为经验常数。
随着反应的继续进行,当熔体含硫量降低到图中b点时,金属铜在Cu2S熔体中的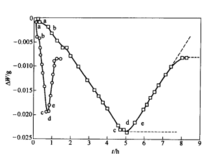 浓度达到饱和并析出,熔体开始分层,上层为含有饱和金属铜的Cu2S熔体,下层为含有饱和Cu2S的铜熔体,体系处于两相共存区。此时,氧化反应只改变熔锍和金属的相对数量,而不改变它们的化学组成,故熔锍的含硫量在反应中保持不变,脱硫速度为一常数,如图7—18中曲线b-c段所示,因此
浓度达到饱和并析出,熔体开始分层,上层为含有饱和金属铜的Cu2S熔体,下层为含有饱和Cu2S的铜熔体,体系处于两相共存区。此时,氧化反应只改变熔锍和金属的相对数量,而不改变它们的化学组成,故熔锍的含硫量在反应中保持不变,脱硫速度为一常数,如图7—18中曲线b-c段所示,因此
-dΔW/dt= k2
式中,k2为常数。
当体系的含硫量降低到c点时,Cu2S熔体氧化时质量变化与时间的关系熔锍相完全消失,体系中只有金属相存在,其中的含硫量很低。随着含硫量的降低,脱硫速度不断减小,如图中曲线c-d段所示,此时,反应速率可以表示为
-dΔW/dt = k3Csm
式中,k3为表观速率常数;Cs为铜液的含硫量;m为经验常数。
最后,当体系中的含硫量为零时,反应速率也等于零,如图中曲线的d点所示。此后,如继续氧化,则金属铜液将被氧化,铜中含氧量将不断增加,质量变化将转变为正值,如图中曲线d-e段所示。待氧化反应进行到e点时,体系又开始分层,氧化速率再次发生转折。2




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国