米氏方程(Michaelis-Menten equation)表示一个酶促反应的起始速度与底物浓度关系的速度方程。1
在酶促反应中,在低浓度底物情况下,反应相对于底物是一级反应(first order reaction);而当底物浓度处于中间范围时,反应(相对于底物)是混合级反应(mixed order reaction)。当底物浓度增加时,反应由一级反应向零级反应(zero order reaction)过渡。
简介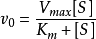 ,这个方程称为Michaelis-Menten方程,是在假定存在一个稳态反应条件下推导出来的,其中
,这个方程称为Michaelis-Menten方程,是在假定存在一个稳态反应条件下推导出来的,其中 值称为米氏常数,
值称为米氏常数,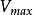 是酶被底物饱和时的反应速度,
是酶被底物饱和时的反应速度,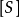 为底物浓度。
为底物浓度。
由此可见 值的物理意义为反应速度
值的物理意义为反应速度 达到
达到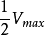 时的底物浓度(即
时的底物浓度(即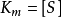 ),单位一般为mol/L,只由酶的性质决定,而与酶的浓度无关。可用
),单位一般为mol/L,只由酶的性质决定,而与酶的浓度无关。可用 的值鉴别不同的酶。
的值鉴别不同的酶。
当底物浓度非常大时,反应速度接近于一个恒定值。在曲线的这个区域,酶几乎被底物饱和,反应相对于底物S是个零级反应。就是说再增加底物对反应速度没有什么影响。
反应速度逐渐趋近的恒定值称为最大反应速度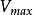 。对于给定酶量的
。对于给定酶量的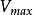 可以定义为处于饱和底物浓度的起始反应速度n。对于反应曲线的这个假一级反应区的速度方程可写成一种等价形式:
可以定义为处于饱和底物浓度的起始反应速度n。对于反应曲线的这个假一级反应区的速度方程可写成一种等价形式:
n(饱和时)=Vmax=k[E][S]0=k[E]total=kcat[ES]
速度常数k等于催化常数k cat,k cat是ES转化为游离的E和产物的速度常数。饱和时,所有的E都是以ES存在。方程(3.2)中还有另一个简单的关系式:Vmax=kcat [E]total。从中得出:kcat=Vmax / [E]total。kcat的单位是s-1。催化常数可以衡量一个酶促反应的快慢。
米氏常数 是酶促反应速度n为最大酶促反应速度值一半时的底物浓度。这可通过用[S]取代米氏方程中的
是酶促反应速度n为最大酶促反应速度值一半时的底物浓度。这可通过用[S]取代米氏方程中的 证明,通过计算可得n=Vmax /2。
证明,通过计算可得n=Vmax /2。
方程推导建立模型1913年Michaelis L.和Menten M.根据中间复合体学说提出了单底物酶促反应的快速平衡模型或平衡态模型(equilibrium-state model),也称为米-曼氏模型(Michaelis-Menten model):
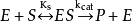
式中E是酶,S是底物,ES是中间复合体,P是产物,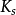 是ES的解离[平衡]常数,即第一步的逆向反应中的速率常数
是ES的解离[平衡]常数,即第一步的逆向反应中的速率常数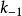 和正向速率常数
和正向速率常数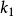 之比
之比 ,
,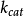 是催化常数,即第二步中的向前速率常数
是催化常数,即第二步中的向前速率常数 。
。
模型假设在建立模型和推导模型的速率方程时,他们实际上做了以下几点假设:
①为了简化起见,假设反应中只有一个中间复合体,反应的第一步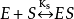 是可逆反应,并保持始终;
是可逆反应,并保持始终;
②反应的第二步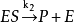 是限速步骤,这里是限速步骤,这里
是限速步骤,这里是限速步骤,这里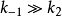 ,也就是说ES分解生成P的速率不足以破坏E和ES之间的快速平衡;
,也就是说ES分解生成P的速率不足以破坏E和ES之间的快速平衡;
③为了达到平衡,只用初始底物浓度[S0] 的很小一部分,因为一般情况下[S0]>>[E0](初始酶浓度),因此在反映的初期,底物浓度[S]可以用[S0] 代替,或是把[S]看作[S0] ;
④酶在反应中不被消耗,只是或以游离形式E存在或以结合形式ES存在,因此游离酶浓度[E]和中间复合体浓度[ES]只和等于初始酶浓度[E0] 或总酶浓度[Et] ,即[E]+[ES]=[E0]=[Et] ,这就是所谓的酶守恒公式(conservation equation of enzyme);
⑤该模型没有考虑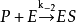 这一逆反应,但显然k-2是一个不等于零的常数,要忽略这一步,必需使[P]接近于零,因此米-曼氏方程只适用于反应的初速率。
这一逆反应,但显然k-2是一个不等于零的常数,要忽略这一步,必需使[P]接近于零,因此米-曼氏方程只适用于反应的初速率。
推导过程根据平衡态模型S转变成P的总速率应由限速反应(模型中第二步)决定,因此产物生成速率
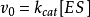
ES复合体的浓度[ES]在实验上不易测定,需要找出容易测定的其他参数(如某些常数和已知的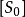 等)来代替它。为此利用第一步反应(快速平衡)中ES解离成E和S的解离常数2
等)来代替它。为此利用第一步反应(快速平衡)中ES解离成E和S的解离常数2
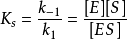
则
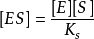
将酶守恒公式 代入上式得
代入上式得
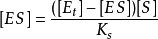
经整理得

代入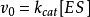 得
得
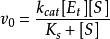
这里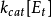 具有特殊的意义。当底物浓度[S]高至使所有酶分子都被饱和时,则
具有特殊的意义。当底物浓度[S]高至使所有酶分子都被饱和时,则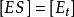 ,反应初速率
,反应初速率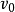 将达到最大值,
将达到最大值,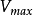 用数学式可表示为
用数学式可表示为
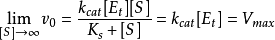
因此 也可写成
也可写成
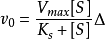
模型改进平衡态模型中前两点假设不具有普遍性,特别是没有理由认为所有酶促反应的 都远小于
都远小于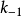 。因此1925年Briggs G. E.和Haldane J. B. S.对该模型提出了修正,但仍保留米-曼氏假设的后三点。他们用稳态模型(steady-state model)或称Briggs-Haldane氏模型:
。因此1925年Briggs G. E.和Haldane J. B. S.对该模型提出了修正,但仍保留米-曼氏假设的后三点。他们用稳态模型(steady-state model)或称Briggs-Haldane氏模型:
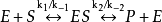
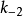 代替了平衡态模型。对观测初速率(即产物P尚未生成或很少生成时)来说,式中仍可忽略不计。所谓稳态是指反应进行不成的一段时间内(顺便提及,几毫秒内,这段时间的状态称为前稳态),系统中[ES]由零增加到一定值,在一定时间内虽然[S]和[P]在不断变化,ES复合体也在不断地生成和分解,但ES的生成速率
代替了平衡态模型。对观测初速率(即产物P尚未生成或很少生成时)来说,式中仍可忽略不计。所谓稳态是指反应进行不成的一段时间内(顺便提及,几毫秒内,这段时间的状态称为前稳态),系统中[ES]由零增加到一定值,在一定时间内虽然[S]和[P]在不断变化,ES复合体也在不断地生成和分解,但ES的生成速率 与分解速率
与分解速率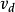 接近相等,[ES]基本保持不变。因此在稳态下ES形成的净速率,
接近相等,[ES]基本保持不变。因此在稳态下ES形成的净速率,
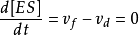
因为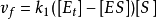 且
且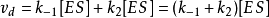
所以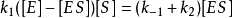
整理得
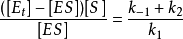
这里,速率是常数之比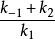 本身也是一个常数,并被定义为米氏常数(Michaelis constant),
本身也是一个常数,并被定义为米氏常数(Michaelis constant), :
:
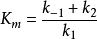
将 代入
代入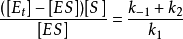 ,整理得:
,整理得:
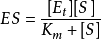
根据稳态模型,S转变为P的速率决定于稳态浓度[ES]和限速的速率常数 。因此
。因此
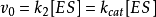
将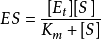 代入上式,得
代入上式,得
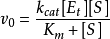
或
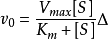
根据两种模型推导出的速率方程形式上是一样的,两者不同的是 比
比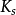 具有更大的普遍性。稳态下,当
具有更大的普遍性。稳态下,当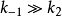 时,则
时,则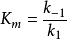 ,因此可以把平衡态看成是稳态的一个特例。为了纪念Michaelis和Menten两人,人们把上述带三角符号的的方程都称为米-曼氏方程(Michaelis-Menten equation)。
,因此可以把平衡态看成是稳态的一个特例。为了纪念Michaelis和Menten两人,人们把上述带三角符号的的方程都称为米-曼氏方程(Michaelis-Menten equation)。
参数意义①当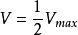 时,
时,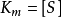 。因此,Km等于酶促反应速度达最大值一半时的底物浓度。
。因此,Km等于酶促反应速度达最大值一半时的底物浓度。
②当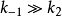 时,
时,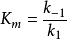 =Ks。因此,Km可以反映酶与底物亲和力的大小,即
=Ks。因此,Km可以反映酶与底物亲和力的大小,即 值越小,则酶与底物的亲和力越大;反之,则越小。
值越小,则酶与底物的亲和力越大;反之,则越小。
③ 可用于判断反应级数:当[S]100Km时,ν=Vmax,反应为零级反应,即反应速度与底物浓度无关;当0.01Km
可用于判断反应级数:当[S]100Km时,ν=Vmax,反应为零级反应,即反应速度与底物浓度无关;当0.01Km




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国