概述
元素呈气态时,从它的一个原子或阳离子中将一个电子移至无穷远处时所需做的功,称为该元素的电离势,单位为电子伏特(ev)。当原子失去第一个电子成为一价阳离子时,所需的能量为元素的第一电离势;当一价阳离子再失去一个电子成为二价阳离子时所需的能量为第二电离势,余类推。第二电离势高于第一电离势,第三电离势又高于第二电离势,如此等等。通常所称的电离势一般都是指第一电离势。电离势愈小,表示愈易失去电子。金属元素的电离势比非金属元素电离势小。根据最新版本无机化学,电离势即为电离能。
电离势定义为:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的能量叫做第一电离能。简言之,第一电离能就是原子失去电子所需要的最低能量。1
基本原理原子失去电子变成正离子时,电子必须消耗能量以克服原子核对电子的引力。1mol基态气体原子失去1mol电子变成气态正离子时消耗的能量称为该元素的第一电离势 (或电离能),常以
(或电离能),常以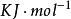 为单位。
为单位。
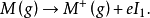
元素原子的电离势越小,说明元素越易失去电子,元素的金属性、还原性越强。对于可失去多个电子的原子,按失去电子的先后次序,对应有第一电离势(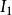 ),第二电离势(
),第二电离势(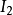 )等。由于价态越高的正电离子对核外电子的有效引力越大,且电子离核距离(相对于不同电子层的电子)越小,因此,总是
)等。由于价态越高的正电离子对核外电子的有效引力越大,且电子离核距离(相对于不同电子层的电子)越小,因此,总是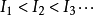
同一周期中元素的第一电离势从左到右总体上呈增大趋势,这主要是由于同一周期元素从左向右电子层数相同,但核电荷数依次增加,原子半径依次减小,核外电子受到的引力也随之加大。其中ⅡA,VA,ⅡB等出现的反常情况是由于这些元素具有洪特规则特例中描述的全充满或半充满的稳定结构。这些反常情况在第一电离势图中表现为两个大峰之间出现的小峰。稀有气体在同周期中第一电离势最大。
同一周期过渡元素的第一电离能,由于受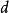 轨道电子的屏蔽,从左向右的增加趋势相对较小,内过渡元素的第一电离能变化则更小。
轨道电子的屏蔽,从左向右的增加趋势相对较小,内过渡元素的第一电离能变化则更小。
周期表中同主族元素的第一电离势从上到下,由于电子层数的增加,原子半径增大,依次减小。因此,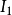 最小的元素是位于左下角的铯(Cs),而
最小的元素是位于左下角的铯(Cs),而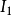 最大的元素是位于周期表右上角的氦(He)。
最大的元素是位于周期表右上角的氦(He)。
总体上看,主族元素所处周期越靠下,元素的金属性越强。同一副族的元素的电离势变化幅度较小,且不大规则。除IIB族外,其他副族元素的金属性有逐渐减小的趋势。2




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国