出品:科普中国
作者:卢霞(中国科学院烟台海岸带所)
监制:中国科普博览
自古以来,追求长生不老一直是人类梦寐以求的理想,人们一直在探寻各种各样有效延缓衰老、永葆青春的方法。从有记载的历史中来看,追求延寿、追求长生贯穿在整个人类发展的主线中。
2005年,Science杂志在创刊125周年公布了125个推动基础科学研究的科学难题,其中“人类寿命到底可以延长多久”排第六位,时隔十六年,于2021年再次发布世界最前沿的125个科学问题,生命科学中排第二位的“我们可以阻止自己衰老吗”仍然为最重要问题之一。因此,细胞中是否真的存在调控衰老进程与寿限的“长寿基因”与“衰老基因”一直是生命科学前沿探索的热点问题。
(图片来源:veer图库)
是什么决定了物种的寿命周期?
在后生动物类群中,不同物种间的寿命周期存在着极大差异,比如线虫与人类由共同祖先urbilaterian分化而来,但二者的寿命周期相差了2000多倍,而与物种间的巨大差异相比,物种内寿命的有限可变性说明寿命周期的多样性取决于特定的遗传因素。究竟哪些遗传因素决定物种的寿命周期,是否所有的后生动物都由相同的基因和途径影响寿命?为解释这些科学问题,生物学家们对几种处于不同进化地位的陆生模式生物(酵母、线虫、果蝇、小鼠等)进行了广泛研究。研究结果表明,基因的确可以影响生物的衰老及寿限,生物寿命的演化来源于基因突变的积累。
目前,关于影响寿命的基因的研究主要是在诱变或敲除等途径获得的突变体中开展,通过这种途径延长寿命的同时,往往会以损害其他健康性能为代价,比如生长、运动和繁殖等性能。因此,在进化中的基因突变自然延长寿命且保持健康的生物将是理想的研究模型。
为什么要研究海洋贝类的寿命?
海洋是生命的起源,物种丰富,其中就有大约20,000种海洋双壳贝类,它们在适应特定的环境中过程中形成了不同的衰老策略,有寿命短于1年的小温水蛤Donax spiculum等,也有寿命长达400年的海洋圆蛤Arctica islandica。说到这里,不得不提科学家们在北大西洋中发现的一只活了507年的蛤蜊,并给他取了个极富诗意的名字“明”,而之所以能够得到这个名字,最主要的原因就是因为这个蛤蜊真的是太长寿了,在这个蛤蜊出生的时候(1499年),我们国家还处于明朝。同为地球生物,为什么这只蛤蜊会如此长寿?研究发现,秘密就在于它生活的低温、缺乏光照的环境(食物匮乏),不仅新陈代谢率更低,而且它无法自己产生热量,产生了更少的氧自由基,而这些有害的分子是线粒体活动的副产品,一直以来也被认为是衰老的原因之一。

(图片来源:北京晚报)
因为海洋双壳贝类结构简单,生活环境复杂,代谢调节快速,参与适应性调控的途径较短,学者们慢慢把视线移向了这类生物身上,提出海洋双壳贝类非常适合作为新的模式生物研究老化和长寿。那么有没有亲缘关系很近但寿命差异 很大的海洋贝类呢?答案是有。
Argopecten属的海湾扇贝(Argopecten irradians)和紫扇贝(A. purpuratus)的亲缘关系非常近,可以进行杂交,甚至部分杂交一代具有繁育能力,也就是说二者是不完全生殖隔离的,但寿命截然不同,海湾扇贝是寿命最短的海洋双壳贝类之一,性成熟后基本停止生长,一般在次年春天产卵后死亡,通常寿命小于14个月,属于典型的短寿命型贝类,而紫扇贝在性成熟后仍继续生长,寿命长达7-10年,是接近于可忽略衰老(Negligible senescence)的类型。据化石推断海湾扇贝和紫扇贝分化于800万年前,两种扇贝随着Atlantic-Pacific板块的闭合分布在了不同海域,紫扇贝生活的环境常年气候变化较小,温度较低,食物相对匮乏,而海湾扇贝生活的环境气候变化波动较大,温度高,食物充沛。在长期适应不同环境的进化过程中,可能形成了不同的营养代谢和衰老策略。这就提示海湾扇贝和紫扇贝可能是研究自然条件下衰老和长寿的理想模型。
亲缘关系如此近的两种贝类,为什么寿命差异这么大?
在进化中紫扇贝的基因如何变异才让它拥有了“长寿”的特异功能?带着这个疑问,中国科学院烟台海岸带所的王春德研究团队开展了相关的研究,基于该团队前期完成的紫扇贝和海湾扇贝的高质量基因组,分析发现PTEN和FoxO的基因结构在两种扇贝中不同,主要表现为PTEN的特征基序HCxxGxxR邻近位点和FoxO邻近AKT磷酸化位点的氨基酸发生了变异。此外,两种扇贝的FoxO在转录激活结构域附近发生了变异,可能会导致不同的FoxO转录活性。研究人员推测这些关键位点的变异可能导致FoxO和PTEN活性的改变,进而影响两种扇贝的寿命周期。
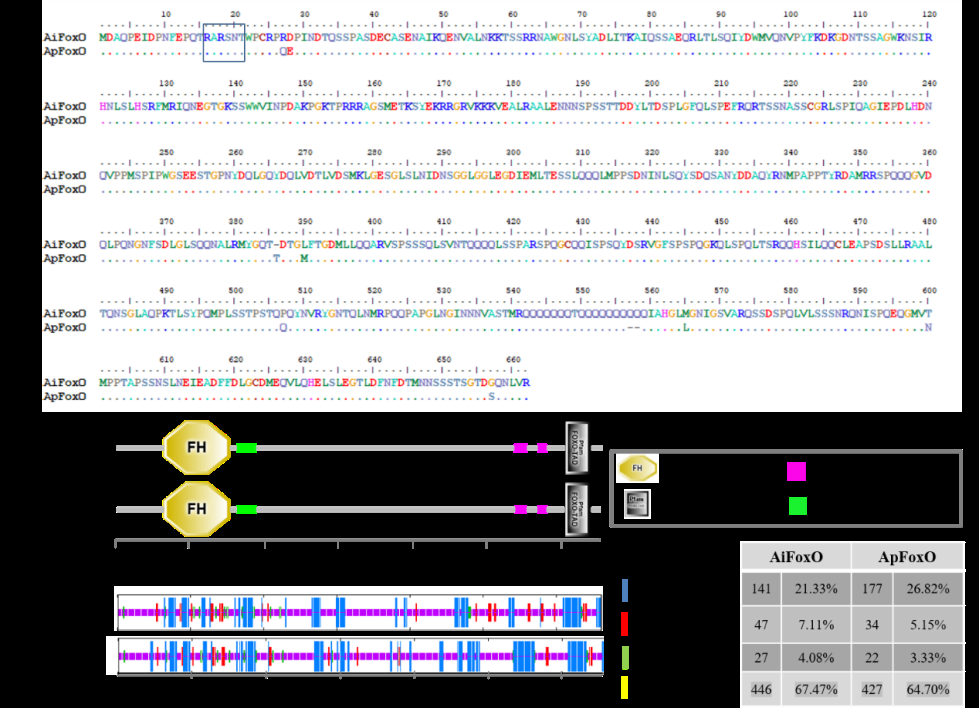
FoxO在海湾扇贝和紫扇贝中的结构差异. 蓝色框指示的是AKT磷酸化位点(抑制FoxO的活性)
(图片来源:参考文献)
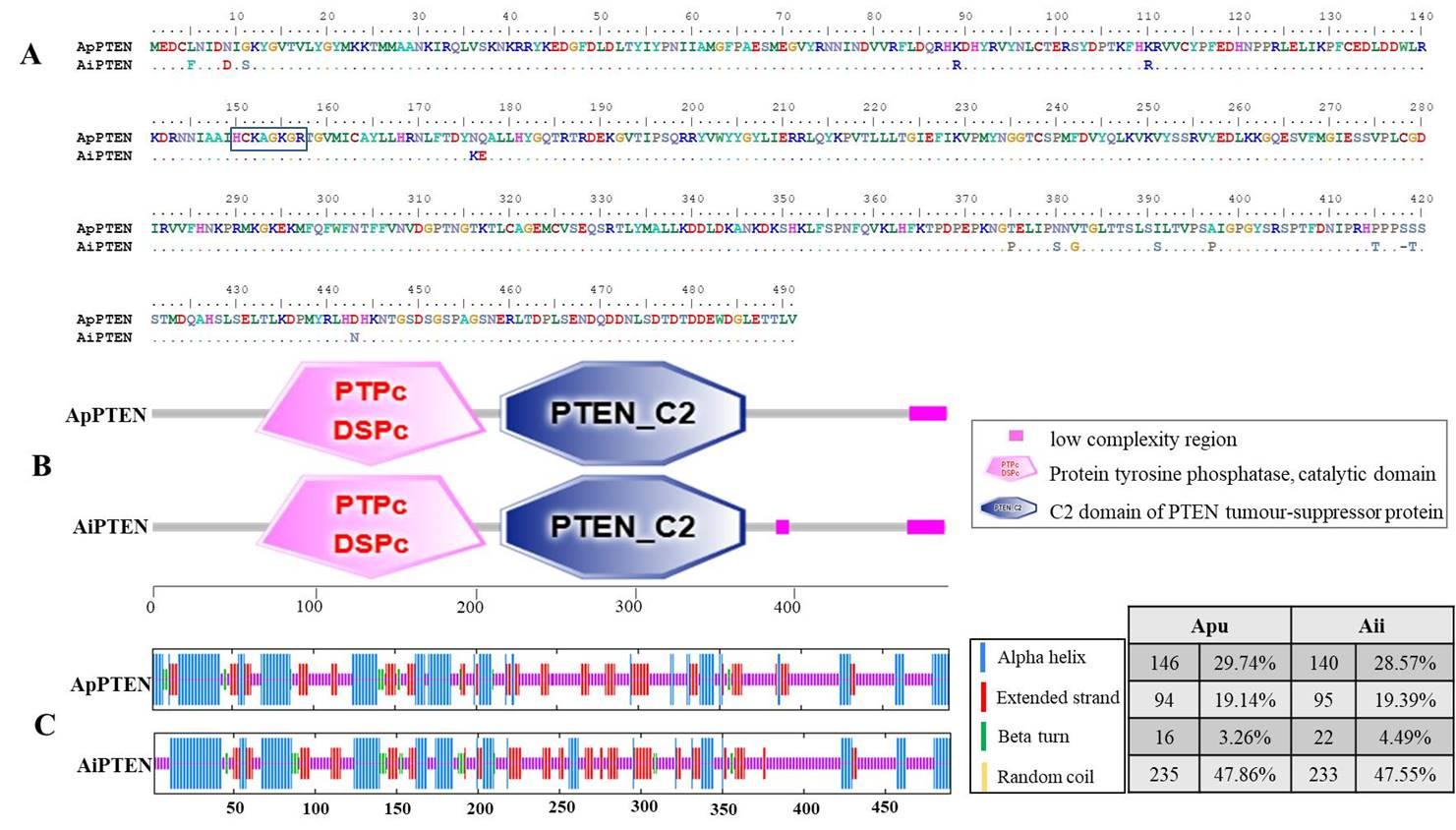
PTEN在海湾扇贝和紫扇贝中的结构差异. 蓝色框指示的是特征基序(该基因催化和磷酸酶活性的关键位点)
(图片来源:参考文献)
FoxO和PTEN是insulin/IGF-1 signaling(IIS)通路的核心基因,在陆生模式生物中该通路中核心基因的完全或部分功能丧失的突变会延长寿命,且营养限制可导致IIS通路活性被抑制,提高FoxO和PTEN的活性,从而延长寿命。中国科学院烟台海岸带所的科研人员,对海湾扇贝和紫扇贝进行了为期两个月的营养限制处理,研究发现营养限制导致两种扇贝的FoxO和PTEN表达均显著上调,但海湾扇贝对营养限制响应速度更快、幅度更大。


营养限制条件下FoxO和PTEN在海湾扇贝和紫扇贝中的响应模式. *p < 0.05; **p < 0.01; ***p < 0.001
(图片来源:参考文献)
接着科研人员对海湾扇贝和紫扇贝进行了电离辐射处理,研究发现刺激后紫扇贝的死亡率显著低于海湾扇贝,表现出更强的抗损伤和修复能力。辐照后FoxO的表达量在紫扇贝闭壳肌中显著升高,而在海湾扇贝中显著降低;PTEN的表达量在紫扇贝闭壳肌中显著升高,而在海湾扇贝中则无显著变化。
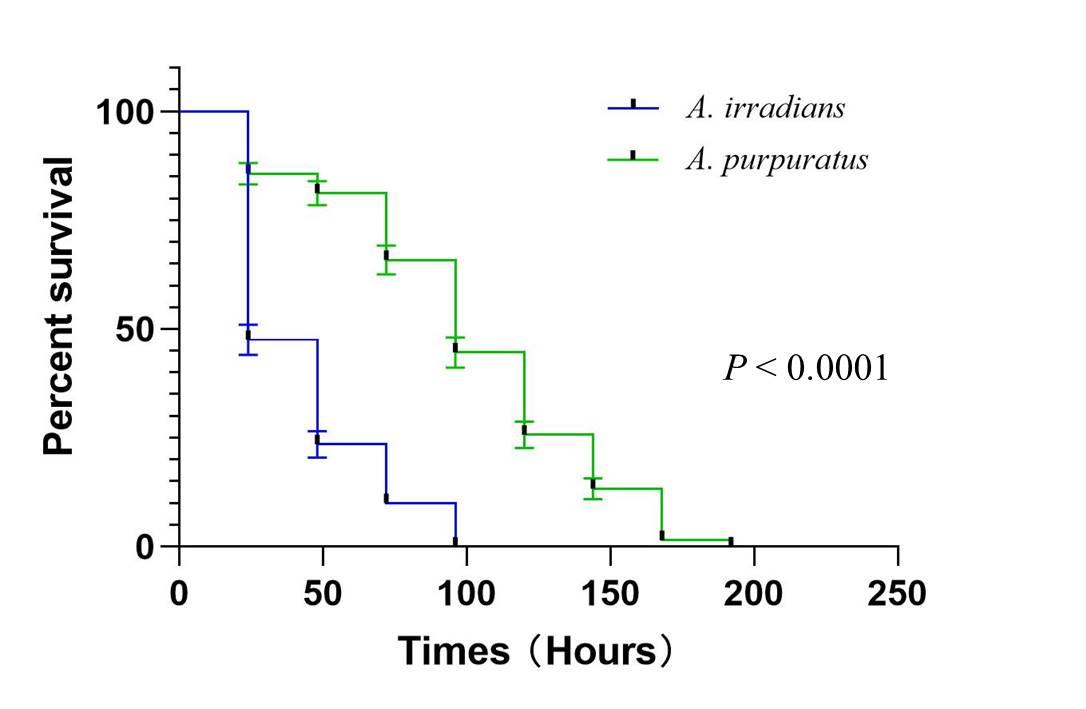
电离辐射后海湾扇贝和紫扇贝的生存曲线
(图片来源:参考文献)
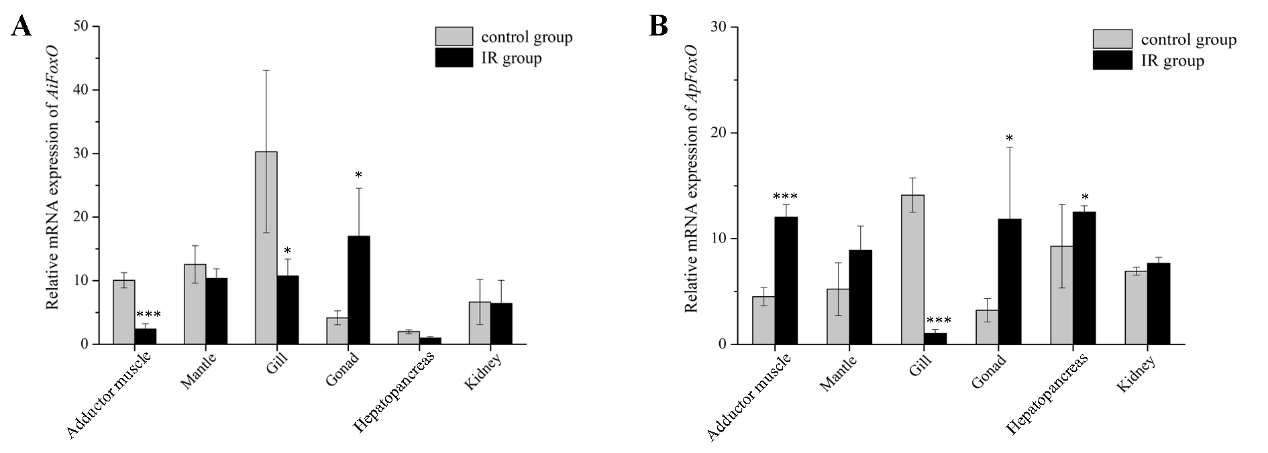

电离辐射后FoxO和PTEN在海湾扇贝和紫扇贝中的表达变化. *p < 0.05; **p < 0.01; ***p < 0.001
(图片来源:参考文献)
最后科研人员敲降(通过一定途径使机体内特定基因短期内被抑制表达)FoxO和PTEN基因的表达,分析了下游抗氧化基因的表达,研究发现抑制FoxO和PTEN的表达后,抗氧化酶SOD和CAT基因的表达量和活性显著降低,同时老化标志酶β-半乳糖苷酶活性显著升高。

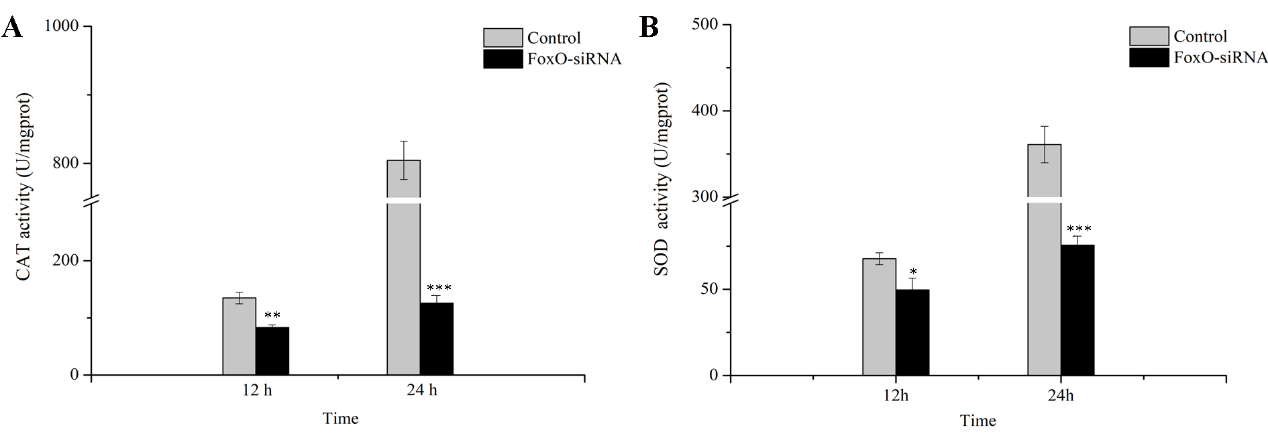
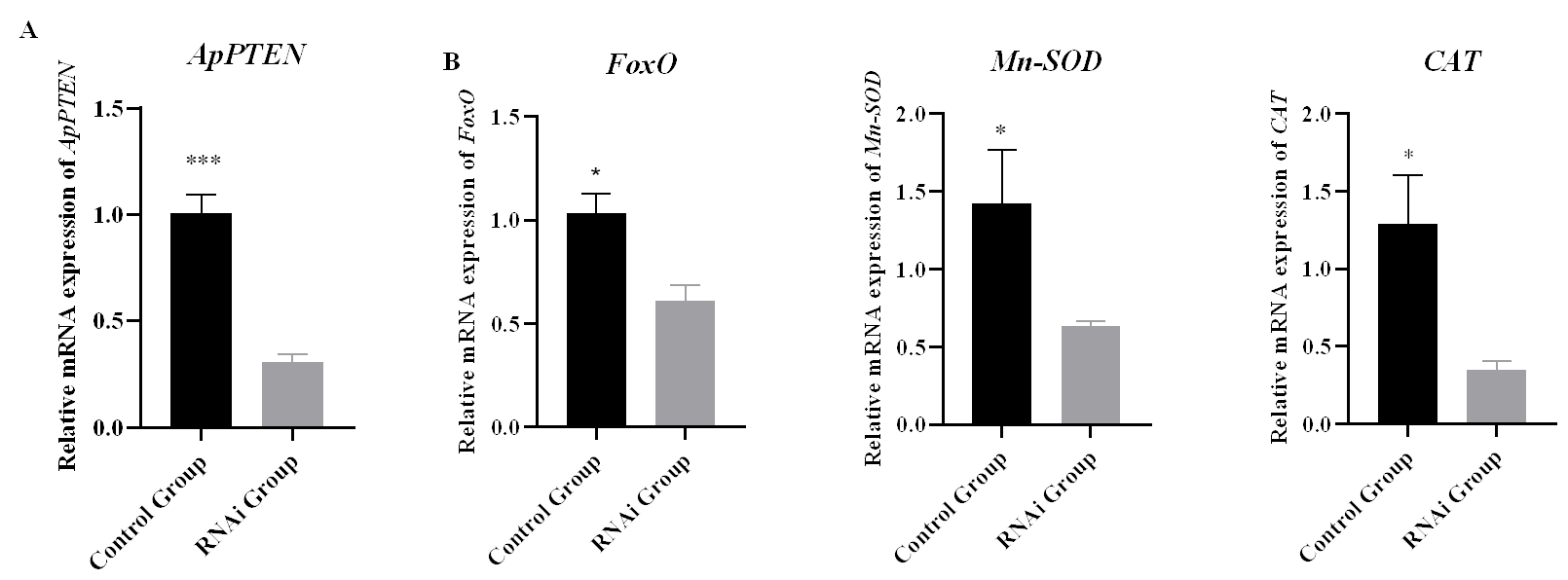
抑制FoxO和PTEN后下游基因的表达变化. *p < 0.05; **p < 0.01; ***p < 0.001
(图片来源:参考文献)

抑制FoxO后老化指标老化标志酶β-半乳糖苷酶活性的变化
(图片来源:参考文献)
这些研究表明IIS通路的核心基因FoxO和PTEN在两种扇贝中的遗传变异,改变其在营养感受、DNA损伤修复、抗氧化等方面的活性,进而影响代谢保护、基因组稳定性维持以及有害自由基消除的能力。
由此可见,我们要想延缓衰老,健康的生活习惯很重要,“管住嘴,迈开腿”,减少自由基的产生。
参考文献:
1.Wang Y, Lu X, Wang C, Ning J, Chen M, Yuan K. Potential roles of FoxO in promoting longevity in larger Argopecten scallops. Aquaculture,2022,561: 738690.
2.Xu H, Lu X, Wang C, Ning J, Chen M, Wang Y, Yuan K. Potential roles of PTEN on longevity in two closely related Argopecten scallops with distinct lifespans. Frontiers in Physiology, 2022,1386.
3.Austad SN. Methuselah's Zoo: What Nature Can Teach Us about Living Longer, Healthier Lives. MIT Press. 2022.
4.Luigi Fontana, Linda Partridge, Valter D. Longo. Extending Healthy Life Span—From Yeast to Humans. Science, 2010, 328: 321-326
5.Abele D, Brey T, Philipp E. Bivalve models of aging and the determination of molluscan lifespans. Experimental Gerontology, 2009, 44(5): 307–15.
(注:文中拉丁文部分应为斜体。)







 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国