近日,中国科学技术大学龙冬教授课题组在膜蛋白取向动力学的核磁共振波谱分析领域取得重要进展,相关成果以“Quantitative Paramagnetic NMR-Based Analysis of Protein Orientational Dynamics on Membranes: Dissecting the KRas4B-Membrane Interactions”为题发表于《美国化学会志》(Journal of the American Chemical Society)。
外周膜蛋白可通过疏水、静电等非共价作用附着于质膜(plasma membrane)表面,并参与分子信号转导在内的诸多重要细胞事件。在膜环境中,蛋白质分子相对脂质双分子层的取向并不固定,而是快速地在不同的取向状态间相互转换,具有不同程度的旋转自由度。近年来的研究表明外周膜蛋白的生物学功能高度依赖其在膜表面的空间取向,并受其旋转动态过程的调控。如何在原子分辨尺度精确表征蛋白质分子在脂质双分子层表面的功能性取向运动是该领域的前沿问题。
在本研究中,龙冬教授课题组发展了针对膜-蛋白二元体系的顺磁弛豫增强分析技术,实现对外周膜蛋白取向图景(orientational landscape)的高精度刻画。该工作发现并定量解释了常规膜顺磁弛豫增强(mPRE)实验中膜内自旋探针泊松分布对质子顺磁弛豫增强速率的扭曲效应,并对不同定性和定量顺磁弛豫参数的失真程度给出了理论评估和实验验证。为消除这一系统误差,该项研究利用瞬时膜-蛋白复合系统准确测量了外周膜蛋白的未失真mPRE速率,并在此基础上发展了一项新的基于mPRE实验参数的建模方法,用于准确还原生物大分子在膜表面的玻尔兹曼取向分布。这一定量mPRE方法被应用于癌基因蛋白KRas4B,精确刻画了其在不同成分磷脂双分子层表面的取向运动,揭示了该分子中催化结构域和C末端天然无序结构区域在塑造其取向图景时起到的独特作用。值得一提的是,作为经典膜外周蛋白,KRas4B与下游效应分子及小分子抑制剂的相互作用受其在膜表面空间取向的严格调控。该项研究工作构建的高精度KRas4B取向动力学模型对深刻理解其信号转导机理和药物设计都至关重要。
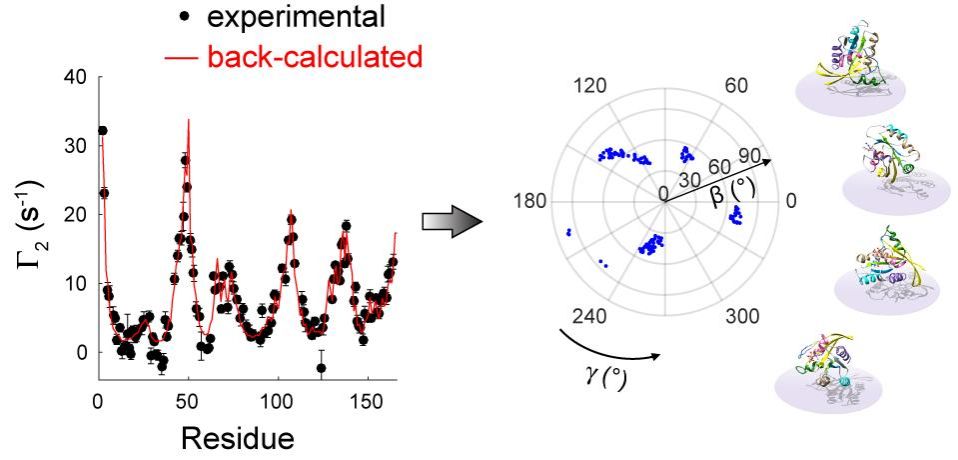
图1.mPRE核磁共振波谱法定量揭示KRas4B在脂质双分子层表面的取向分布





 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国