嗅觉是人体最早形成的感官之一,其重要性或许因为它在我们的生活中过于平常而被忽视。嗅觉不是仅仅在享用美食、感受环境危险时起作用,它与记忆、情感也有着密切关系。那么,我们为什么能闻到气味?这是一个很基础,但又极为复杂的问题。对嗅觉受体的探索,是寻找答案的关键。
撰文 | 陈庆超(剑桥大学MRC分子生物学实验室博士后)
在多样化的物质世界中,有一种世界,我们看不见摸不着,却能真真切切地感受到。它或是来自雨后泥土和青草的芬芳,或是来自餐桌上美食飘香的诱惑,它甚至存在于记忆中,连起情感的细流,这便是“气味的世界”。
气味有数以百万计不同种类,每种气味都由数百个化学分子组成,其性质各不相同。我们为什么能感受并辨别如此复杂多样的气味?长期以来,这是生物学上较少探索但极为重要的科学问题之一。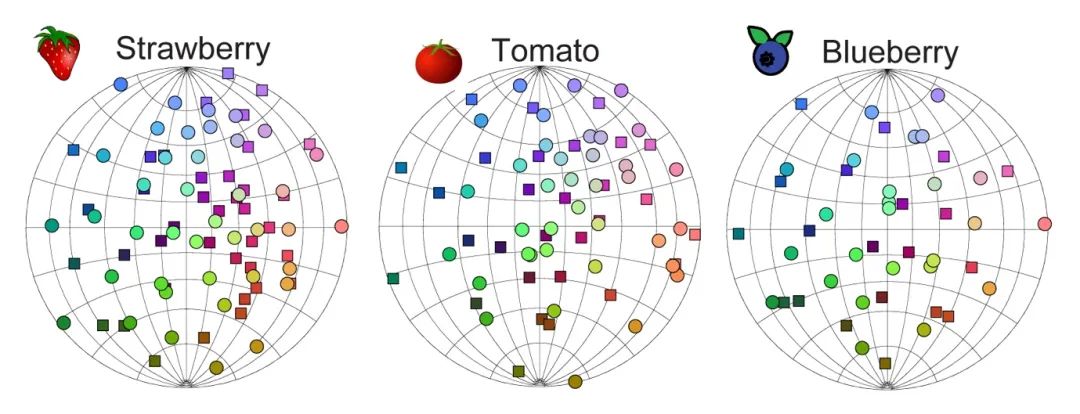 图1. 常见的蔬果(草莓、番茄和蓝莓)散发的气味中所包含的气味分子。每个圆圈和正方形均代表一种气味分子。| 图源:salk.edu
图1. 常见的蔬果(草莓、番茄和蓝莓)散发的气味中所包含的气味分子。每个圆圈和正方形均代表一种气味分子。| 图源:salk.edu
事实上,“感受”和“辨别”是两个不同的生物学问题:一是我们的嗅觉系统如何感知复杂多样的气味分子;二是我们的神经系统如何解码气味信号以形成不同的嗅觉感知。本文主要关注于第一个问题,跟大家分享几十年来嗅觉受体结构研究的探索历程。
探寻嗅觉受体嗅觉是人体最早形成的感官之一,这是一种非常复杂的感官反应。通过数以百万计的嗅觉神经,我们能够感知和区分各种具有不同结构特性的小分子化合物,即气味分子,即使浓度非常低 (微摩尔甚至纳摩尔浓度范围)。[2]
人体鼻腔黏膜中覆盖着被称为嗅觉上皮的组织,其中生长着大量嗅觉感觉神经元并相互连接。嗅觉感觉神经细胞通过纤毛延伸到鼻腔内的粘液层。我们闻到某种气味的过程如下(图1):气味分子进入鼻腔黏膜,被嗅觉感觉神经元的初级纤毛感知从而激活嗅觉神经细胞,并产生化学信号;这些化学信号触发神经细胞产生电信号,然后通过嗅觉神经传递至位嗅球,再传递至嗅皮层(大脑负责嗅觉处理的皮层区域)。在嗅皮层中,大脑对传入的嗅觉信息进行分析和识别。最终,嗅觉神经信号的处理形成了描述各种气味的语义表征,例如咖啡味、玫瑰味、芒果味,等等。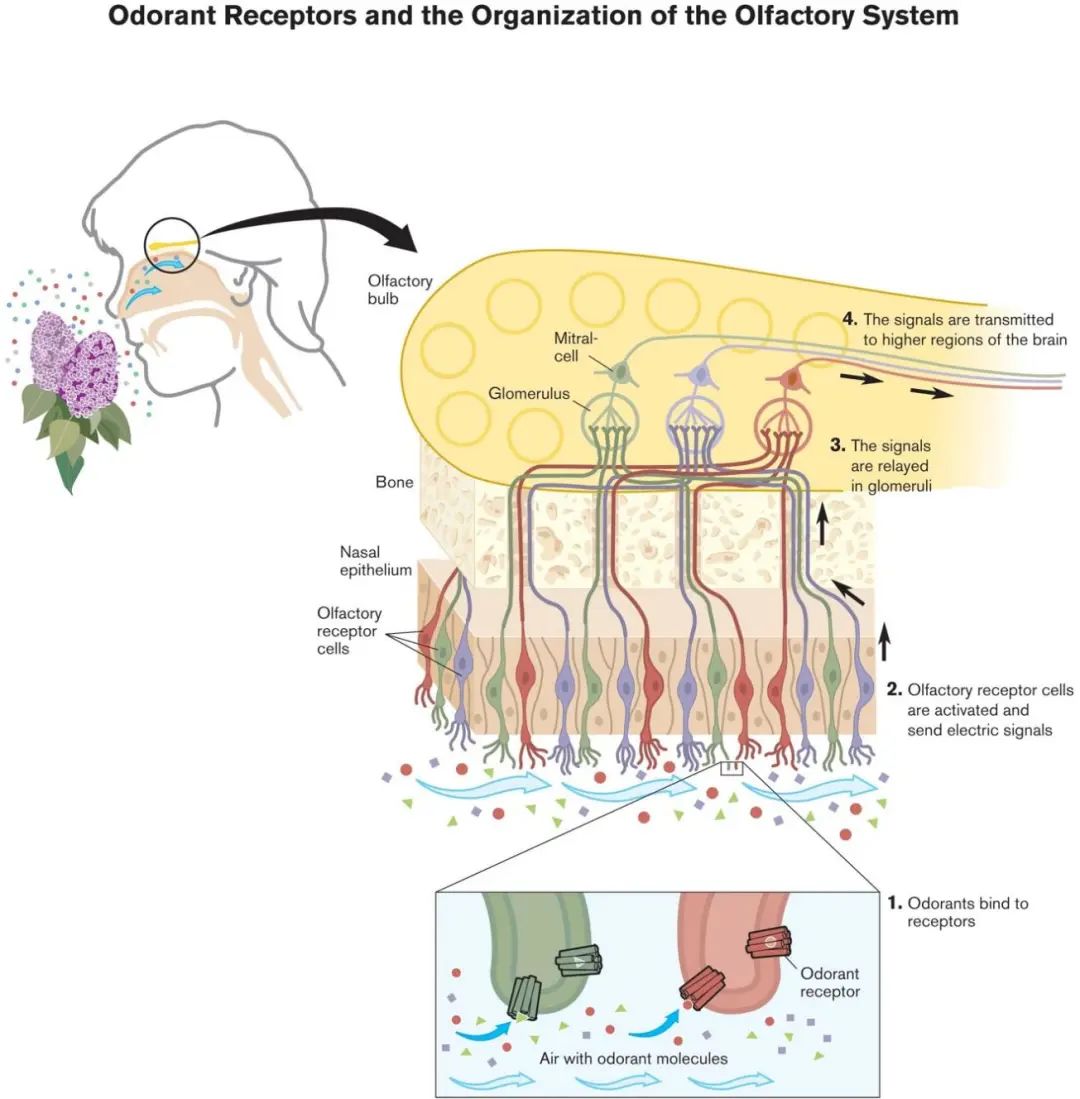 图2. 人体嗅觉系统的示意图。从气味感受、信号传递到最终信息处理。| 图源:nobelprize.org
图2. 人体嗅觉系统的示意图。从气味感受、信号传递到最终信息处理。| 图源:nobelprize.org
长期以来,嗅觉研究领域的一个关键问题是,细胞如何感受复杂多样的气味分子。一种合理的假设是,嗅觉感觉神经细胞上存在一种特殊的蛋白质,被称为“嗅觉(气味)受体”(Ordorant Receptor,OR),用于探测气味分子。一直以来,科学家都在力求找到这些特殊的嗅觉受体蛋白。
20 世纪 80 年代中期,不同研究组进行的一系列生理生化实验表明,气味激活嗅觉感觉神经元是由 G 蛋白依赖性通路介导的。
G蛋白是细胞内非常重要的一类信号转导分子,它通过与G 蛋白耦联受体(GPCR)协同工作,将激素、神经递质等各种信号因子产生的信号传递至细胞内,并进一步调节酶、离子通道、转运蛋白以及其他各种蛋白的功能。在嗅觉神经元内,G蛋白介导腺苷酸环化酶的激活,细胞内环磷酸腺苷(cAMP)浓度的增加,cAMP门控离子通道的激活和神经元去极化**[4]。
同一时期,一些嗅觉特异基因相继被克隆,其中就包括编码 G蛋白和 cAMP 门控离子通道的基因,进一步证实了 G蛋白信号通路在气味信号转导中的重要作用,这些研究强烈暗示嗅觉受体很可能是G 蛋白耦联受体(GPCR)。
1991年,Linda Buck 和 Richard Axel 在Science杂志上发表了一项开创性的研究工作——首次从大鼠中克隆并鉴别了嗅觉受体GPCR基因家族[6]**。通过进一步的分析,他们还证明这些受体只在大鼠嗅觉上皮细胞中表达,而不在其他八个组织(包括大脑、视网膜和肝脏等)中表达。此外,为了估计嗅觉基因家族的大小,它们还进一步使用DNA的混合物作为探针,筛选大鼠基因组文库。当时的筛选结果显示,大鼠单倍体基因组包含至少 500-1000 个嗅觉受体基因。
Buck 和Axel随后独立地展开工作,进一步在人类嗅觉组织中发现了嗅觉受体GPCR基因的存在,并确认它们在人类嗅觉系统中的重要作用。
这些开拓性的工作,为我们理解和研究神秘的嗅觉感知奠定了重要基础,由此两人获得了2004年度诺贝尔生理学或医学奖。 图3. 2004 年诺贝尔生理学或医学奖共同授予Richard Axel(左)和Linda B. Buck(右),以表彰他们“发现气味受体和嗅觉系统结构”。| 图源:nobelprize.org
图3. 2004 年诺贝尔生理学或医学奖共同授予Richard Axel(左)和Linda B. Buck(右),以表彰他们“发现气味受体和嗅觉系统结构”。| 图源:nobelprize.org
2004年以后,人类基因组计划的完成使得鉴定和分类人类嗅觉受体基因成为可能,进一步推动了嗅觉受体研究的发展。
现在,我们知道嗅觉受体主要是具有七次跨膜结构的G 蛋白耦联受体(GPCR)。GPCR在人体里面有超过800个家族成员,是真核生物中最大的细胞表面受体家族,它们参与了人体几乎所有生命活动的调控。正因如此,GPCR成为了科学研究的“明星分子”和药物研发的重要靶标。在美国食品药品监督管理局(FDA)批准的所有药物中,约三分之一通过靶向调控不同GPCR的活性来发挥作用**[7]**。而在人体所有的GPCR中,约有400个成员被归类为嗅觉受体,占据了GPCR成员的一半,是其中最庞大的蛋白家族。
嗅觉受体结构解析的困境自1991年首次发现嗅觉受体以来,结构生物学家一直致力于解析嗅觉受体的结构,以阐明其识别气味分子的机制。然而,近30年以来,嗅觉受体结构的解析工作进展并不顺利,面临诸多挑战。
首先,大部分人类嗅觉受体主要在鼻腔神经细胞中表达,且表达水平较低。因此,直接在人源的组织样本中很难获得足够量的蛋白(通常是毫克量级)用于结构解析工作。而异源表达(在动物细胞或细菌中表达)的效果也不理想, 不仅表达水平非常低,还会由于错误折叠导致不具备生物活性。
第二,为了解析GPCR的蛋白结构,我们需要结合一些特定的高亲和性的配体分子,也就是合适的气味分子。然而,由于气味分子巨大的化学多样性,以及嗅觉受体的成员众多,目前尚缺乏一种高效的方法来确定一个给定的嗅觉受体与哪些气味分子相互作用。
现在学术界逐渐认识到,每个嗅觉受体可以与所有潜在气味分子的一个子集相互作用,一种气味分子可以激活多个嗅觉受体,不同受体对不同气味分子具有不同的亲和力。这种相互作用的复杂性导致大量的嗅觉受体并未找到合适的气味分子配体,这些受体被成为“孤儿受体”( orphan receptors )[8]。目前很多“脱孤”的研究工作正在进行,开发有效的筛选方法,为孤儿受体寻找合适的配体。此外,由于大多数挥发性气味分子是疏水性分子,溶解度很低,这大大增加了气味分子配体的制备难度。
第三,作为细胞膜上进行信号感受和转导的重要分子,GPCR是高度动态的蛋白分子,它在非激活、半激活、激活以及和不同调控分子耦联等各种构象中不断变化。因此,和其他大多数GPCR类似,嗅觉受体纯化的一个难点在于稳定受体蛋白处于特定的构象,而这对于蛋白晶体的形成非常重要。
近年来,多个研究组相继开发了很多的方法去稳定GPCR的不同构象,包括但不限于通过稳定性突变法获得稳定性高的受体突变体用于蛋白结晶;通过结合“迷你 G 蛋白(miniGs)”来稳定与G蛋白耦联的GPCR完全活性状态下的结构;结合高亲和性小分子配体(包括激动剂、拮抗剂、反向激动剂等);开发新型纳米抗体(Nanobody)来稳定GPCR不同复合物构象等。对于一个特定的GPCR而言,需要尝试很多不同的方法去稳定特定的构象,这是一个非常耗时费力的过程。
曙光初现:从昆虫到人如今,结构生物学已经从晶体衍射跨入冷冻电镜的时代。在一个完整的单颗粒冷冻电镜技术中,纯化过的蛋白被瞬间冻结在一层薄薄的非结晶玻璃体冰中,再经由透射电镜成像,记录下几十万到几百万个蛋白颗粒数据——用于三维重构和精确建模(图4)。与传统的晶体学手段相比,单颗粒冷冻电镜技术(Cryo-EM)在解析生物大分子高分辨率结构方面具有明显优势,例如无须获得晶体、所需样品量小和样品制备方式多样等,且已被广泛应用于解析GPCR与下游蛋白的复合物结构,这为嗅觉受体结构的解析带来了曙光。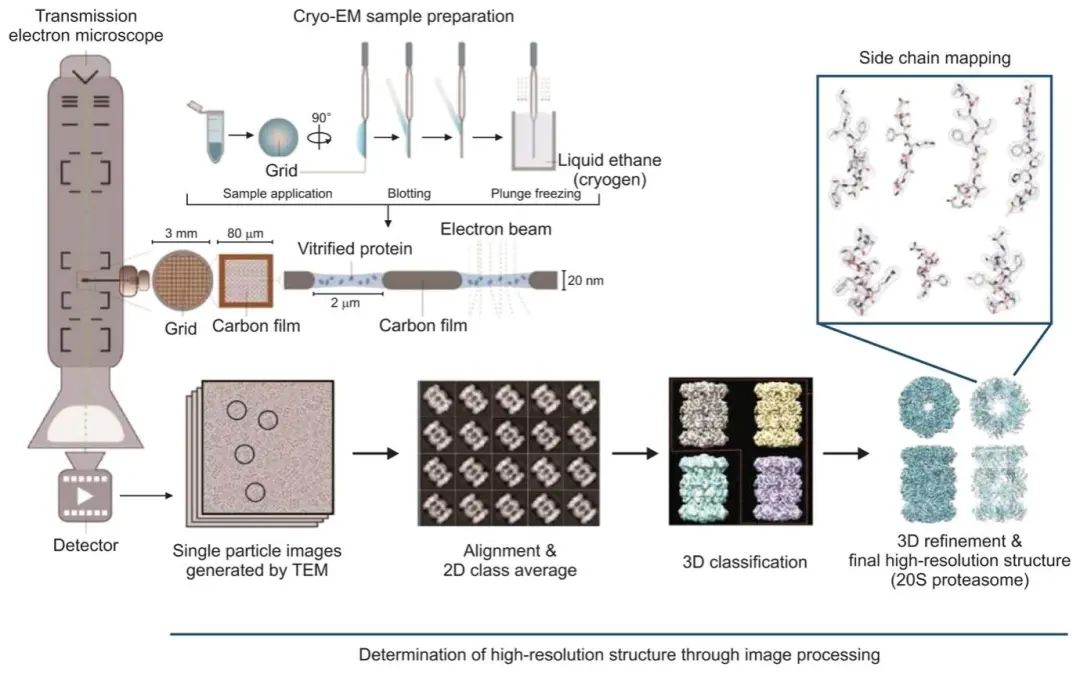 图4. 单颗粒冷冻电镜(Single Particle Cryo-EM)基本工作流程:将纯化的蛋白样品置于网格,然后用液体乙烷玻璃化, 嵌入薄冰中的蛋白颗粒将具有各种随机方向,通过透射电子显微镜(TEM)成像,然后通过一系列图像处理进行三维重构,最终得到高分辨率的蛋白冷冻电镜结构。| 图源:pdf.medrang.co.kr
图4. 单颗粒冷冻电镜(Single Particle Cryo-EM)基本工作流程:将纯化的蛋白样品置于网格,然后用液体乙烷玻璃化, 嵌入薄冰中的蛋白颗粒将具有各种随机方向,通过透射电子显微镜(TEM)成像,然后通过一系列图像处理进行三维重构,最终得到高分辨率的蛋白冷冻电镜结构。| 图源:pdf.medrang.co.kr
2018年,美国洛克菲勒大学Ruta实验室的研究人员以近3.5 Å 的分辨率解析了一种寄生黄蜂的气味辅助受体Orco 的单颗粒冷冻电镜结构**[9]。与哺乳动物不同,昆虫气味受体不是GPCR,而是门控离子通道,是由气味受体OR和高度保守的辅助受体 Orco 组成的异多聚体离子通道。这个离子通道如同一个带电粒子流过的孔,只有当受体遇到它的目标气味分子时才会打开,从而激活嗅觉感觉细胞。长期以来,科学界对于Orco 是否可以作为独立的嗅觉受体发挥功能存在争议,并没有形成统一的昆虫气味感受和信号转导模型。这项工作首次展示了昆虫气味辅助受体Orco同源四聚体的精细结构,为确定 “昆虫嗅觉辅助受体Orco可以形成一类新型异聚配体门控离子通道”提供了结论性的证据,得到结构解析并确认了其功能,为理解昆虫周围嗅觉机制提供了重要的新见解。
2021年,同样来自Ruta实验室的另一项研究工作解析了一种石蛃的嗅觉受体OR5的冷冻电镜结构[10]**(图5)。通过比较OR5结合三种不同气味分子的结构,研究者发现气味分子结合主要依赖于疏水相互作用,缺乏其他经常介导配体识别的分子间作用力(如氢键)所固有的严格的几何约束。
疏水相互作用是一种稳定蛋白质三维结构的作用力,通常发生在两个或多个非极性氨基酸残基中。当它们处于极性环境(最常见的是水)中时,对水的“厌恶”导致它们以某种方式相互靠近,以便尽可能少地与极性环境相互作用。这种非特异的弱相互作用为解释“一种嗅觉受体为何可以识别不同的气味物质”提供了一种新的机制,有别于其他许多受体配体相互作用的经典“锁与钥匙”模型。但OR5受体的非特异性并不意味着它没有偏好性,尽管它可以结合许多不同的气味分子,但也对很多其他的气味分子并不敏感。此外,如果对一些结合口袋中的氨基酸进行简单突变,即重新改变受体,受体则可以结合原本不喜欢的分子。这个发现也有助于解释昆虫为何能够在进化过程中通过突变进化出数百万种气味受体,以适应它们遇到的各种生活环境,形成独有的生活方式。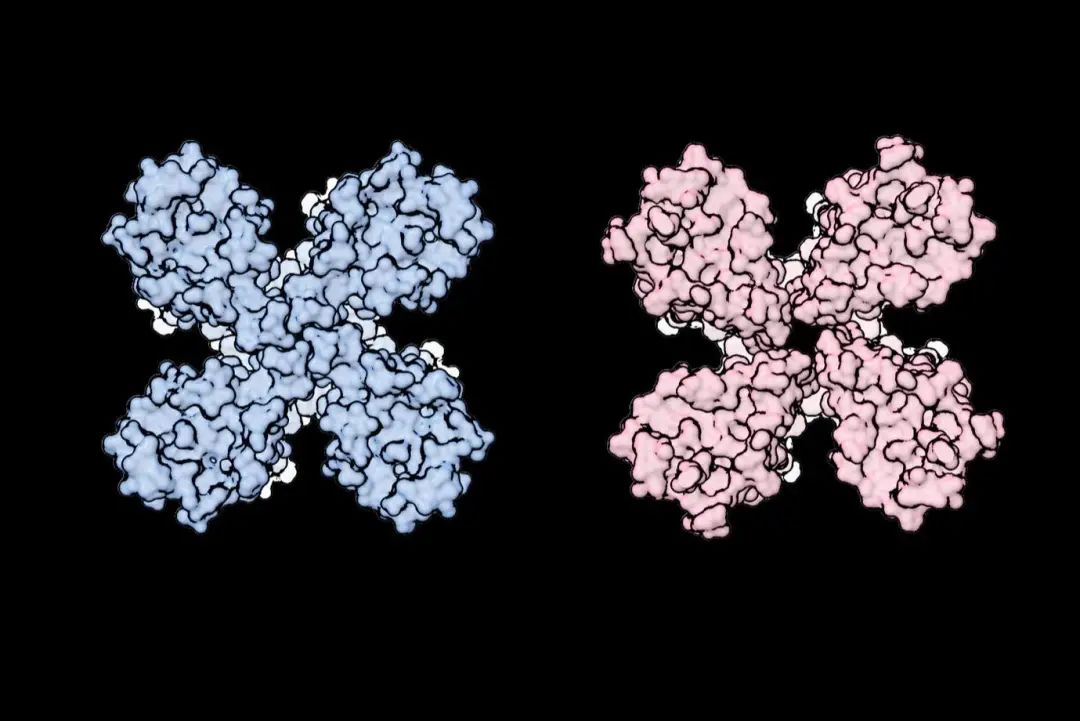 图5. 石蛃的嗅觉受体OR5的冷冻电镜结构。当气味分子与嗅觉受体结合时,嗅觉受体的通道孔(蓝色)会扩张(粉红色)。| 图源:rockefeller.edu
图5. 石蛃的嗅觉受体OR5的冷冻电镜结构。当气味分子与嗅觉受体结合时,嗅觉受体的通道孔(蓝色)会扩张(粉红色)。| 图源:rockefeller.edu
以上这些关于昆虫嗅觉受体的结构生物学研究为我们理解气味识别机制带来了很多新的认识,但人和昆虫毕竟是不同的,我们迫切需要人源嗅觉受体的高分辨率结构以揭开人体嗅觉感受的“面纱”。
直至2023年3月,Nature杂志发表的一篇文章首次为我们揭示人体嗅觉受体结构的奥秘**[11]**。
在这项工作中,研究者选择了被称为OR51E2的嗅觉受体。他们之所以选择这种受体,是因为它不仅在嗅觉神经细胞中表达,也在其他非嗅觉器官如前列腺中表达,这表明其更易于在异源系统中表达。也就是说,更易获得足够的蛋白。
这种受体的匹配分子也很容易获得。前期研究已经表明这个受体可以结合并响应水溶性的短链脂肪酸(short chain fatty acids, SCFAs)气味分子——丙酸。短链脂肪酸是肠道菌群产生的一类信号分子,容易挥发,有特殊的刺激性气味,并在许多疾病的发生、发展中起重要作用。
此外,OR51E2在进化过程中较为保守,可能是因为它们识别了对许多物种的动物生存至关重要的气味,研究者推断这种嗅觉受体可能在进化上更多地受到稳定性的约束。
简而言之,通过这些策略,研究者巧妙地规避了大多数嗅觉受体低表达水平,大多数挥发性气味剂的低溶解度和纯化嗅觉受体高度不稳定性的挑战。通过融合表达迷你G蛋白,以及结合Gβ1γ2 蛋白和纳米抗体Nb35等策略,研究者稳定了OR51E2和丙酸结合的一种激活状态,并利用冷冻电镜解析了其三维高分辨率结构(图6)。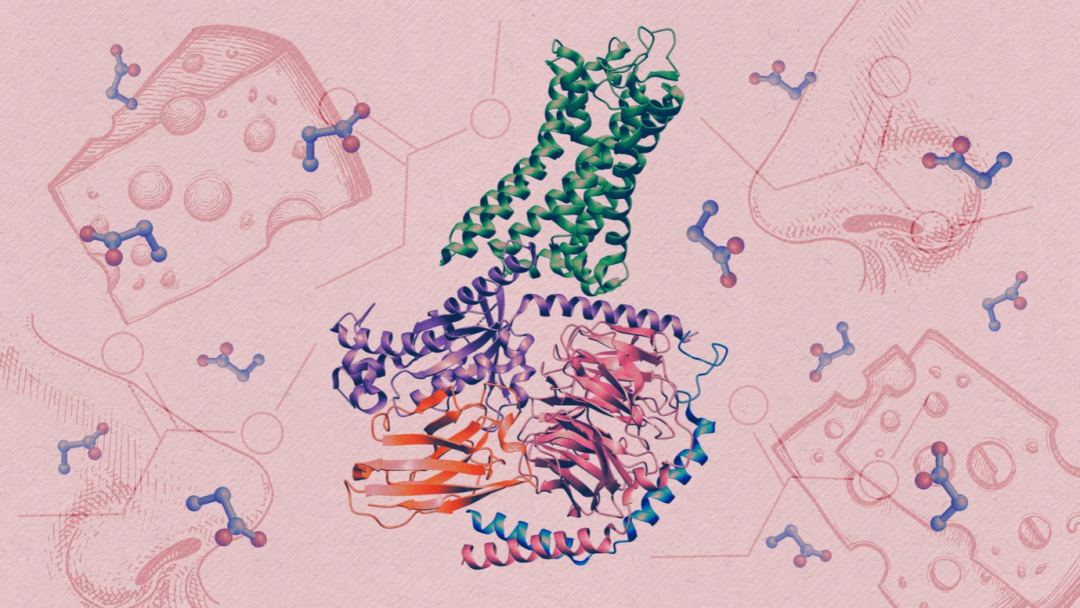 图6. 人类气味受体 OR51E2(绿色)的 3D 结构。紫色、红色和蓝色螺旋和缠结是与受体耦联的 G 蛋白亚基,橙色是用来稳定结构的纳米抗体。|图源:Kristina Armitage/Quanta Magazine; Sources: NIH/NIDCD; ArtBalitskiy/iStock; Alhontess/iStock
图6. 人类气味受体 OR51E2(绿色)的 3D 结构。紫色、红色和蓝色螺旋和缠结是与受体耦联的 G 蛋白亚基,橙色是用来稳定结构的纳米抗体。|图源:Kristina Armitage/Quanta Magazine; Sources: NIH/NIDCD; ArtBalitskiy/iStock; Alhontess/iStock
在这个结构中,OR51E2 受体将气味分子丙酸锁在一个很小的闭合结合口袋中。在这个小口袋中,丙酸通过两种类型的相互作用与 OR51E2 结合:极性相互作用(氢键和离子键),以及非特异性的疏水相互作用。因此,OR51E2 结合气味分子的方式不同于昆虫气味门控离子通道,似乎选择性更强。
许多嗅觉受体能够对各种化学性质不同的气味剂做出反应,而OR51E2似乎只与短链的脂肪酸结合。那么是什么因素决定了这种选择性呢?对此结构的进一步分析表明, OR51E2 对短链脂肪酸的选择性源于封闭结合口袋的体积(31 Å ),它可以容纳短链脂肪酸,例如乙酸和丙酸,但是会阻止更长的脂肪酸链结合。因此,研究人员认为结合口袋的体积是气味分子的重要选择性因素。
作为第一个发表的人源嗅觉受体和气味分子配体结合的激活态结构,这是一个令人欣喜的研究成果,它让我们第一次直观地看到气味分子是如何与嗅觉受体结合的,尽管它在诸多方面并不完美,比如受体和G蛋白的耦联。
配体与GPCR的结合通常会引起构象变化,从而使 G 蛋白耦联,进一步将信号传递给G蛋白。在生理条件下,哺乳动物嗅觉受体可以与两个高度同源的G蛋白Gαolf和Gαs结合。而在这个结构中,研究者并没有耦联Gαolf或Gαs,而是采用融合表达miniGαs,以及结合Gβ1γ2 和纳米抗体Nb35稳定了受体和G蛋白异三聚体的结构。尽管发现了一些嗅觉受体和G蛋白的相互作用,但这并不足以解释和体内真正的G蛋白Gαolf和Gαs的相互作用机制。
2023年5月24日,山东大学基础医学院孙金鹏实验室在Nature杂志在线发表了一项工作,系统解析了小鼠痕量胺嗅觉受体TAAR9(mTAAR9)识别4种内源性胺类配体(苯乙胺,二甲基环己胺,尸胺,亚精胺)并与下游Gαs及Gαolf蛋白耦联的结构**[12]**。
痕量胺相关受体(trace amine-associated receptor, TAAR)是脊椎动物中进化保守的一类G蛋白偶联受体,可以感受纳摩尔浓度的痕量胺(trace amine)。痕量胺是由氨基酸脱羧形成的,对于在动物来说,它可作为感受一系列刺激的气味分子,如判断捕食者或猎物的存在、交配伴侣的接近和食物的变质,并根据气味引起种内或种间吸引或厌恶的反应。近年来,越来越多的研究表明人体内痕量胺与多种精神紊乱相关,TAAR也因此成为精神分裂症、抑郁症和药物成瘾等精神疾病潜在的治疗新靶点。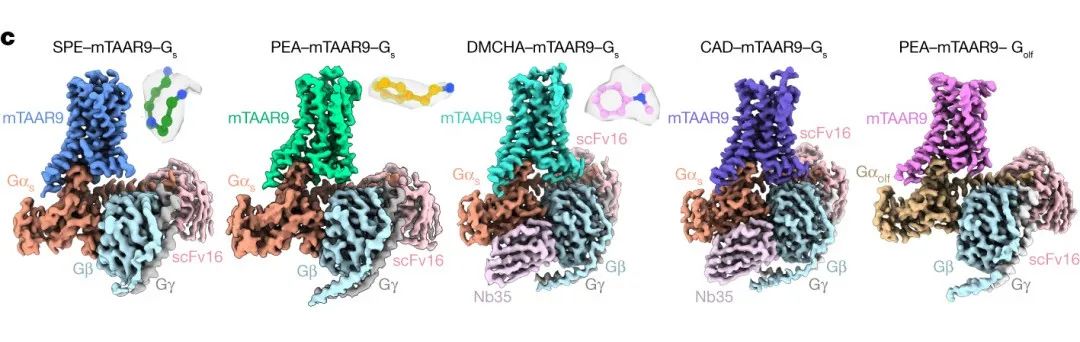 图7. 不同配体结合的小鼠嗅觉受体mTAAR9与Gas及Gaolf蛋白三聚体复合物的结构。| 图源:Nature
图7. 不同配体结合的小鼠嗅觉受体mTAAR9与Gas及Gaolf蛋白三聚体复合物的结构。| 图源:Nature
在这项研究中,研究人员发现嗅觉受体TAAR在N端和第二个胞外段之间形成了一对二硫键,这在其他已知结构的GPCR受体中从未发现过,而且这对二硫键对于mTAAR9识别配体及稳定受体激活态的胞外构象至关重要。
单个TAAR嗅觉受体可以识别多种胺类气味分子,而同一种胺类气味分子也可以被多个嗅觉受体识别,这种相互作用的复杂特性是嗅觉感受胺类分子的重要基础。这项研究发现了mTAAR9识别胺类气味分子的通用结构基序以及识别不同胺气味分子的组合结构基序,为胺类气味分子识别提供了新的见解。
值得注意的是,研究者还解析了mTAAR9受体与两种下游G蛋白Gαs和Gαolf耦联的分子结构。作为第一个实验确定的嗅觉受体和Gαolf的复合物结构,这为下游G蛋白耦联后哺乳动物嗅觉受体完全激活提供了重要的认识。
未来的挑战在冷冻电镜的加持下,嗅觉受体结构解析工作已经初见端倪,更大的挑战也随之而来。
以上结构揭示的只是一种激活态构象,但在生理状态下,嗅觉受体是高度动态的。随着人工智能在蛋白结构预测领域的高度发展,研究者也试图通过计算机模拟展示受体的动态变化以完善理论模型,但这并不能完全等同于真实生理状态下的结构变化。我们需要解析更多嗅觉受体不同时间动态下的结构,以及开发高分辨率的受体蛋白动态监测方法,来帮助我们打开完整的嗅觉感受的生物“黑匣子”。
近年来,随着测序技术的不断发展,在更多的非嗅觉组织中也发现了嗅觉受体的表达,包括心脏、呼吸道、肾脏、肝脏、肺、皮肤、大脑等部位。这些嗅觉受体在非嗅觉组织中的表达既有普遍性,又有特异性。有研究表明鼻腔外表达的嗅觉受体在特定的组织中具有特定的生物学功能**[13]**。一些研究发现,嗅觉受体的功能异常与神经系统疾病和肿瘤等疾病的发生和发展有关。解析这些受体在非嗅觉组织中的生理结构,为嗅觉受体结构研究提供了新的方向和挑战,这些嗅觉受体将来也有望成为重要的药物靶标。
回到本文最开始的那个问题:我们的嗅觉系统为什么能感受并辨别如此复杂多样的气味?在科学上,目前我们还是不能完整回答这个问题,并且当我们对嗅觉受体结构的研究更多、理解更深的时候,这个问题似乎变得更为复杂了。嗅觉受体如何选择性地对空气中的气味分子做出反应,只是更大的气味难题的一部分,研究人员仍然面临更为复杂的挑战:了解大脑如何将受体传导的电化学信号转化为气味的感知。
理解嗅觉感知的奥秘,我们还有很长的路要走。




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国