2019年8月29日,日本大阪大学的研究团队利用iPS细胞诱导而成的角膜组织,使一位因角膜病变遭受失明痛苦的女性患者重见光明。此报道一出,立刻引起公众强烈的好奇与期待。
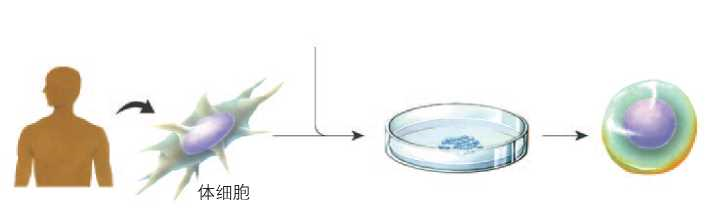
诱导多功能干细胞(iPS细胞)为人工多能干细胞,是将人的皮肤等体细胞经过多能性诱导因子的导入、培养,制成的具有分化成人体各种组织脏器并具有无限增殖能力的细胞。目前,它已经成为治疗疑难杂症的一种新思路。
肌肉骨化症又称进行性肌肉骨化症(FOP),是世界范围内的罕见病之一,全球病例不超过千人,日本全国只有80个患者,至今没有有效的治疗药物。
该病的主要症状是肌肉里会形成多余的骨组织。患者从孩童时期,全身肌肉包括肌肉周围的膜、肌腱、韧带等部位逐渐变硬钙化。四肢肌肉钙化,将导致手脚关节活动范围变窄、指头弯曲;脊椎骨钙化,将导致背部变形;口腔肌肉及和呼吸相关的肌肉钙化,将导致进食困难和呼吸衰竭,患者最终将在痛苦中走向死亡。
2018年11月2日,日本京都大学iPS细胞研究小组报告称,他们利用iPS细胞技术筛选出了几种可能对FOP有治疗效果的候补药物。虽然宣称人类战胜FOP这种疾病还为时尚早,但对于在痛苦中挣扎的患者而言,这项研究不啻为照进黑暗中的光芒。
这项历时3年的研究,是世界上首次利用iPS细胞筛选抑制肌肉钙化药物的成功尝试。虽然要获得真正可用于临床的药物,还必须进行大量的试验,但是这次人类在肌肉骨化症的研究和治疗领域取得了重大突破。
iPS细胞除了可以用来建立药物分析筛选模型,还可以用于器官移植与组织移植领域。比如,可以利用iPS细胞进行软骨缺损后的修复。
软骨组织由软骨细胞和基质组织构成,在人体中大量存在于关节处。在遭到严重损伤后,软骨组织很难自我修复或再生,这就极可能引发软骨缺失的后果,严重影响患者的生活品质。目前主要用移植患者自身健康软骨组织的方法来治疗软骨缺损。不过,这种方法有较大可能引起软骨细胞变性,生成纤维状结构,使移植效果不佳。
日本京都大学iPS细胞研究所的骨组织移植研究小组利用健康人的iPS细胞分化出软骨细胞,再进一步形成软骨组织,最后将组织片移植到患者软骨缺损处。该方法的好处是可以严格控制移植用软骨细胞的高品质,并且不需要以患者自己的组织作为来源。目前,研究人员正在小鼠身上进行实验。
在再生医疗领域,除了将iPS细胞用于软骨疾病治疗,研究者也尝试将iPS细胞分化成心脏组织、胰腺组织、视网膜组织等。该方法简单来说,就是先从患者体内提取iPS细胞,在体外将iPS细胞分化成心肌组织、角膜组织、神经组织、血小板、胰岛等,再将这些组织移植到患者患部,最终弥补或者代替缺损组织。iPS细胞疗法为先天性心脏病、视网膜变性等疑难杂症的治疗提供了全新的视角,相关研究已经取得了显著的进展。
iPS细胞和干细胞有何不同
iPS细胞与干细胞的最大区别就在于,它并非直接来源于人体器官和组织,而是一种通过基因编辑而来的干细胞。例如,首次发现它的日本科学家山中伸弥便是利用病毒载体将4个转录因子的组合转入分化的体细胞中,使其重新编程而得到的类似胚胎干细胞的诱导性多能干细胞。而世界各地不同的科学家陆续发现的其他方法,同样也可以制造这种细胞,只需要根据其类型,选择相应的制备方式。
iPS细胞的优势有哪些?
首先,它类似于胚胎干细胞,具有强大的分化再生能力,可以分化成人体各个器官和组织所需要的各种细胞类型。其次,它是通过遗传编辑而来的一种干细胞,因此在来源方面不存在社会伦理问题。最后,它可以通过CRISPR-Cas9基因编辑产生同基因对照细胞系。该基因编辑可以改变DNA,达到使用细胞治疗人类疾病的目标。






 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国