椎间盘退变可导致慢性腰痛和运动障碍的系列症状,其发病率随人类寿命的延长而不断上升,给社会造成了沉重的经济负担。
目前的治疗手段包括非手术治疗和手术治疗,但只能暂时消除一部分症状,不能恢复椎间盘的正常组织结构和固有功能,且存在诸多并发症。
针对退变椎间盘中细胞数量减少、功能减退这一现象,细胞疗法可向椎间盘内补充新鲜细胞,增加髓核中蛋白多糖和胶原的含量,恢复椎间盘正常的组织结构和生物力学功能,有望实现椎间盘再生。
腰疼,已经成为现代年轻人的通病。
其中,引起腰疼最普遍的疾病就是腰椎间盘突出,这已经不再是中老年人特有的疾病了,随着现代人缺乏锻炼,坐姿不良,身体素质差,20几岁就出现腰椎问题的也大有人在。
随着患有腰椎疾病的人越来越多,临床上的治疗策略也变得繁多起来,比如针灸、推拿等物理疗法,牵引治疗,封闭治疗,甚至是手术治疗。尽管90%的患者都能通过治疗缓解疼痛,然而,剩下的10%治疗难度仍然很大。
面对众多的临床患者,有没有更好的尝试呢?
椎间盘退变的原因与机制
椎间盘由髓核、纤维环和软骨终板组成。髓核中蛋白聚糖带有大量阴离子,渗透压高,可吸水膨胀将压缩负荷转化为对纤维环的拉伸作用,纤维环则起到张力“皮肤”的作用以限制髓核膨胀。
退行性椎间盘疾病源于遗传因素和环境之间的相互作用。年龄、吸烟、感染、遗传易感性、异常生物力学负荷、软骨终板营养供应减少等因素均可能导致椎间盘发生退变。
椎间盘退变始于髓核,早期改变为髓核中蛋白多糖降解增加。这使得髓核含水量降低,生物力学性能减弱,所能承担的压缩负荷减小,更多负荷直接作用于纤维环。
由于纤维环的结构特点,其抵抗压缩的能力远不如抵抗拉伸的能力,因承受了较大的压缩负荷,纤维环结构发生破坏,纤维环整体膨胀,超过终板边界,造成影像学上的椎间盘膨出。
随病变进展,内层纤维环先行破裂,造成包裹性椎间盘突出,进而外层纤维环也发生破裂,髓核完全突破纤维环,引起非包裹性椎间盘突出。
凸入椎管或侧隐窝区域的髓核可能压迫马尾和神经根,引起疼痛、运动障碍等症状。因椎间盘本身缺乏血液供应,一旦变性、损伤,很难自我修复。
传统疗法
退行性椎间盘疾病的治疗手段包括非手术治疗和手术治疗,首选非手术治疗,无效时需考虑手术治疗。
目前常用的治疗方法包括髓核等离子射频消融、臭氧治疗7、突出髓核摘除、椎间融合术等。上述疗法虽然可消除疼痛,但可能加速邻近节段椎间盘的退变,导致相邻椎间盘病变。
由此可见,当前的治疗手段只能消除或缓解部分疼痛,无法实现椎间盘再生和恢复正常的椎间盘功能,且存在较多并发症,弊端较为明显。
细胞疗法
近年来,对椎间盘退变病理生理学研究为椎间盘再生疗法开辟了新途径。髓核内常驻细胞通过维持细胞数量和细胞外基质以维持髓核的正常功能,而退变椎间盘以细胞减少、细胞外基质丢失和高度降低为标志。
研究发现椎间盘退变与髓核细胞丢失有关,在各种因素作用下,髓核细胞功能减退,细胞外基质合成代谢和分解代谢之间的平衡被破坏,蛋白多糖含量减少,Ⅱ型胶原逐渐被I型胶原取代,髓核组成成分改变,椎间盘功能减退并可能引发盘源性腰痛。
由于髓核细胞起到了维持椎间盘稳态的重要作用,细胞疗法为治疗退行性椎间盘疾病提供了一种潜在的解决方案。
这种治疗策略是指将健康细胞输送到椎间盘中,以补充丢失的细胞并增加蛋白多糖和胶原的含量,进而恢复椎间盘正常的组织结构和生物力学功能。
间充质干细胞
间充质干细胞(MSCs)是一个多潜能细胞的异质性群体,具有多能性,可向成骨、成软骨、成脂肪等方向分化,有修复受损组织的潜力,是目前在骨组织工程中应用最为广泛的成体干细胞。研究表明MSCs可分化为髓核细胞样表型,有望成为椎间盘修复的理想细胞来源。
西班牙穆尔西亚Virgen de la Arrixaca大学的科学家Noriega等在行业期刊Transplantation上发表了题为Intervertebral disc repair by allogeneic mesenchymalbone marrow cells: A Randomized controlled trial(同种异体骨髓间充质细胞修复椎间盘:一项随机对照试验)的临床观察报告,该研究将24例诊断为腰椎间盘退变且保守治疗无效的慢性背痛患者随机分为2组,随机对照试验发现将BM-MSCs注入退变椎间盘后,病人的各项功能指标均有显著改善(ClinicalTrials.gov NCT01860417)。
韩国抱川中文医科大学的科研人员Kumar等在行业期刊Stem Cell ResTher上发表了题为Safety and tolerabilityof intradiscal implantation of combined autologous ad-ipose-derived mesenchymal stem cells and hyaluronicacid in patients with chronic discogenic low back pain:1-year follow-up of a phase I study(间充质干细胞和透明质酸联合椎间盘内植入治疗慢性椎间盘源性腰痛患者的安全性和耐受性:一项I期研究的1年随访)的临床观察报告,该研究招募了10名符合条件的慢性腰痛患者,进行了为期12个月随访的单臂I期临床试验,研究证实了间充质干细胞和透明质酸联合注射疗法的安全性和耐受性:实验组病人疼痛改善,椎间盘含水量增加,验证了该疗法的有效性(下图)。
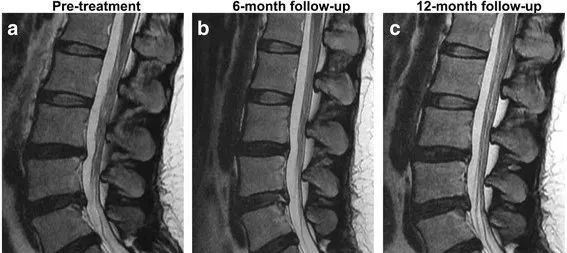
图:T2加权磁共振成像对椎间盘退变程度的评估。矢状T2加权图像(a治疗前)显示L4/5椎间盘的信号强度在6个月时从IV增加到III(b)和12个月(c),表明水含量增加(情况1)
诱导性多能干细胞
诱导性多能干细胞(induced pluripotent stem cells,IPSCs)在多能性方面类似于胚胎干细胞,但伦理问题较少。虽然MSCs是目前广泛应用于骨组织工程的种子细胞,但其再生潜力似乎随年龄增长而下降,IPSCs为解决这个问题提供了可行方案。目前应用IPSCs治疗椎间
盘退变主要有两个方面:诱导其分化为脊索细胞或髓核样细胞。
分化为脊索细胞:在青少年椎间盘中,髓核内主要是脊索细胞,成年后脊索细胞消失,取而代之的是更小的软骨样细胞,目前认为这些细胞由脊索细胞分化而来。研究发现脊索细胞是成熟椎间盘髓核内所有细胞的胚胎前体细胞,脊索细胞的耗竭可能会影响髓核的正常功能。脊索细胞在刺激髓核细胞合成糖胺聚糖和蛋白多糖方面起着重要作用,一些体外实验也表明脊索细胞可控制髓核细胞合成蛋白多糖,有望成为治疗椎间盘退变的种子细胞。
分化为髓核样细胞:IPSCs也可分化为髓核样细胞。根据脊索细胞和髓核细胞的发育情况证实了一种可促进IPSC在体外分化为髓核样细胞的培养基补充方案,这种髓核样细胞有再生椎间盘的潜力。
总之,椎间盘退变的病理过程较为复杂,目前尚未完全阐明。基于退变椎间盘内细胞数量减少、功能减退这一现象,研究者希望通过补充椎间盘内细胞达到恢复正常细胞外基质,逆转椎间盘退变这一目的。椎间盘疾病已取得了一定进展。随着研究的不断深入,在不久的将来,细胞治疗有望成为一些椎间盘退变疾病病人的治疗选择。
免责声明:内容来源于网络,版权归原作者所有。本文为科普性知识,仅作信息交流之目的,不做商业用途,如涉及作品内容、版权和其它问题,请联系我们删除END





 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国