导读
今年诺贝尔生理或医学奖授予两位学者——卡塔琳·卡里科以及德鲁·魏斯曼,以表彰他们在mRNA技术上做出的开创性贡献。
得益于他们的发现以及创新技术,新冠疫苗才能被快速研发出来,挽救了数以百万计人的生命,如今这项技术也在应用到其他病毒、癌症等领域。

最近,我们邀请了业内资深专家徐亦迅博士深度解读mRNA技术。
尽管今年的诺奖没有奖励mRNA递送方面的专家,但徐博士认为,“未来不排除脂质纳米颗粒,有单独获得一次化学奖的机会。”
徐亦迅 | 嘉宾
周 晨 | 整理
01 mRNA疫苗领域两位先驱问鼎诺奖
问:今年诺贝尔生理或医学奖授予mRNA疫苗领域,您觉得是在意料之中还是意料之外?
徐亦迅:两年前,我就期待着他们能获得诺贝尔奖,所以今年他们获奖我并不觉得意外,反而感觉晚了两年。这一延迟可能对很多重要的决策也有一定影响。

宾夕法尼亚大学为两位学者获得诺奖进行庆祝
02 两位获奖者的主要贡献
问:您能评价一下这两位获奖者的主要贡献吗?为什么是这两位科学家而没有第三位可以分享这次诺贝尔奖?
徐亦迅:mRNA技术作为疗法的应用可以追溯到很早以前。举例来说,人体内缺失某种基因后,补充蛋白在操作上会比较复杂,蛋白合成的成本也非常高。多年以来,尝试去改变DNA一直被视为是不可能的任务,直到2012年CRISPR技术的发明,才让便捷的基因编辑成为可能。
mRNA的发现可以追溯到1961年,但在2012年之前,我们很难想象能够轻松编辑DNA。我们应该记得中心法则,即mRNA在DNA和蛋白之间承载遗传信息。
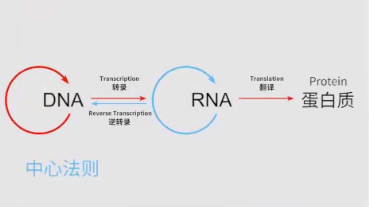
mRNA具有明显的优势。如果将mRNA导入体内,去补充那些缺失或变异的蛋白,它有一个最大的好处:由于它不改变DNA,所以是一个非常安全的疗法,只要没有反转录酶存在,一般不会整合进人类的基因组。
此外,mRNA在翻译成蛋白后通常很快会降解。一旦mRNA疗法可能出现副作用,它会被及时降解,并且它不会整合进基因组,一旦停止这种治疗,可能出现的有害副作用就会逆转,这也是为什么mRNA疗法如此吸引人的原因。
然而,要达到这一点,无论是将mRNA作为疗法还是疫苗,都需要解决一个问题:因为mRNA本质上与病毒和细菌相似,一旦以外来途径进入人体细胞,很容易被人体的先天免疫系统识别为潜在病原体,并产生强烈的炎症反应,在这种情况下无法实现治疗或者疫苗的效果。
两位科学家在2005年发表的《Immunity》杂志上的论文是一个里程碑式的工作。
在所有的诺贝尔颁奖历史上,一直强调,从0到1的突破比从1到100的突破更为重要。
问:除了这两位教授之外,还有其他学者在这一领域做出过重要贡献吗?如mRNA的递送技术方面。
徐亦迅:我在两年前的讲座中也提到了脂质纳米颗粒技术的重要性。卡塔琳·卡里科和德鲁·魏斯曼在他们的公开演讲中也强调了纳米脂颗粒(LNP)技术对新冠mRNA疫苗研发成功的重要性。
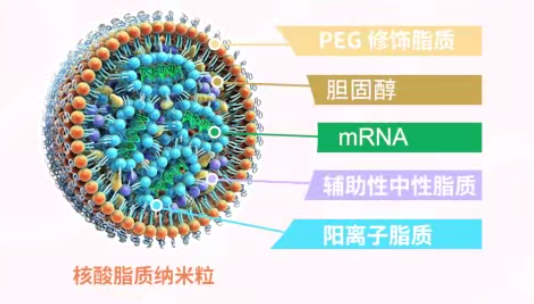
然而,由于诺贝尔奖的名额有限,卡里科和魏斯曼是必得的,只剩下一个名额。如果将这个名额给予纳米脂颗粒(LNP),大家也是可以接受的。后来我们知道彼得·库里斯(Pieter Cullis)似乎在所有纳米脂颗粒方面都是一个非常突出的人选。一些奖项确实让他与卡里科和魏斯曼共同分享。

LNP开创者之一彼得·库里斯(Pieter Cullis)

但诺贝尔委员会的标准往往强调从0到1的突破,而不是从1到99。
不过未来,不排除脂质纳米颗粒有单独获得一次化学奖的机会。
03 mRNA技术发展历程
问:1962年科学家发现了mRNA,但直到60年后,mRNA疗法才逐渐成熟。在这期间,科学家先后解决了mRNA的稳定性、免疫源性和递送问题。您能简单回溯一下这个疗法的发展历程吗?
徐亦迅:在两年前的直播讲座中,我分享了一张图,展示了从1961年到2008年间的mRNA发展历程,实际上是一个非常形象的发展历史。
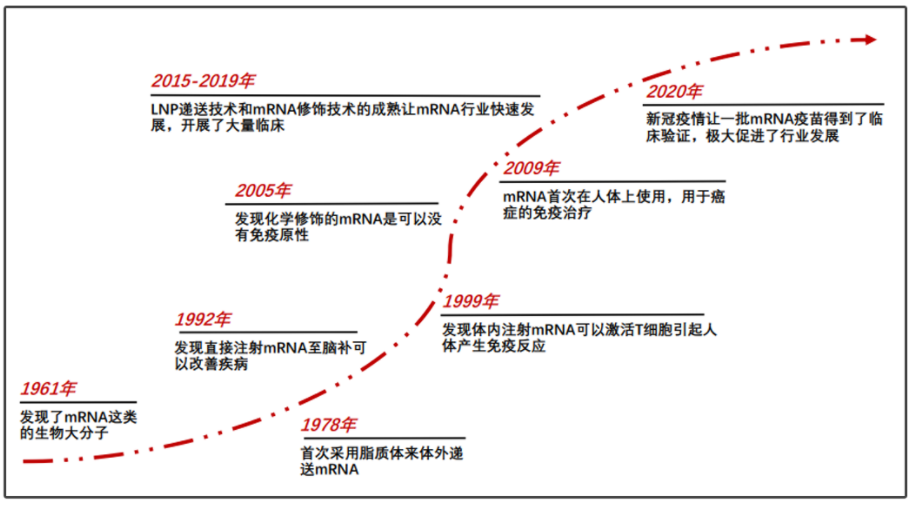
1961年,多家实验室同时发现了mRNA,此时已有很多人认为这项发现可能获得诺贝尔奖。然而我估计或许由于人数众多,所以很难确定哪三个人获奖。mRNA的发现与诺奖擦肩而过令人遗憾。
随着分子生物学的不断发展,面临的首要挑战之一是降低合成mRNA的成本。按照中心法则,DNA到mRNA的转录,以及mRNA到蛋白的翻译是关键步骤。首先要做的是在体外,即试管中,将DNA片段转录成mRNA。在1985年之前还没有PCR技术,得到大量DNA片段的价格都比较高。
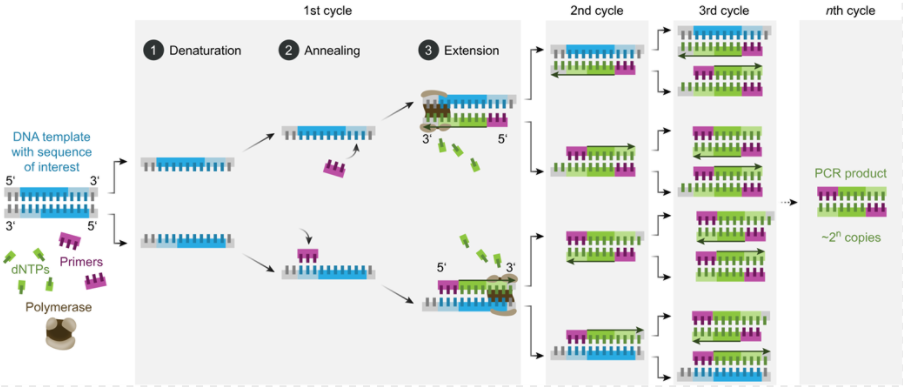
聚合酶链式反应
有了PCR技术后,科学家可以轻松获得足够的模板DNA,利用RNA聚合酶在体外进行转录,就可以轻松获得大量mRNA。然而,研究人员需要解决mRNA的稳定性问题,因为它容易被降解。卡里科和魏斯曼通过引入核苷的修饰,解决了外源mRNA引发炎症反应以及其翻译被干扰素抑制的技术困难。随后,逐渐找到能够合适应用的疾病。
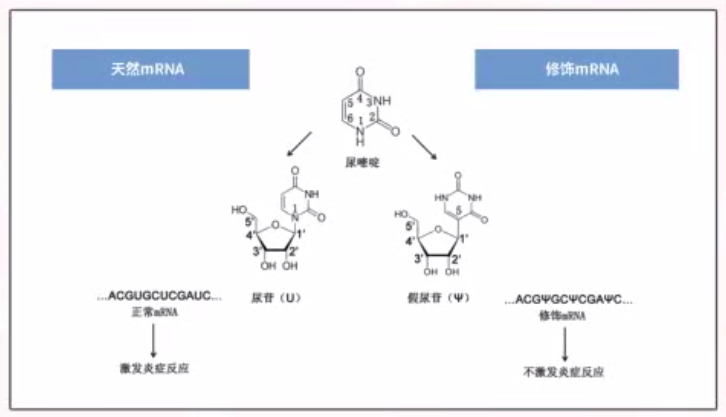
但在之后,将mRNA用作疗法在许多疾病中常面临各种困难,并非所有疾病都可以轻松尝试mRNA作为疗法。
04 mRNA技术在疾病领域的应用
问:mRNA技术因新冠疫情而被人广泛熟知。除了应对传染病,它在肿瘤以及其他疾病领域也大有可为。您能否谈谈您在这方面的看法?
徐亦迅:这是一个非常有趣的问题。实际上,我们可以深入研究两家凭借mRNA新冠疫苗成功的公司:BioNTech和Moderna。
BioNTech公司成立于2008年,是德国一家优秀的生物技术公司。初创时的目标是用mRNA技术来研发肿瘤产生新抗原的癌症疫苗。很多年内都没考虑制作传染病疫苗,直到新冠疫情爆发让他们“灵机一动”,通过结合mRNA的核苷修饰技术加上2017年取得突破的纳米脂颗粒,组合起来可以来应对新冠疫情的挑战。
而Moderna公司早期更早想要开发mRNA疗法,很多公司给它投钱。但当新冠来袭时,他们将主攻方向的一部分转向扩增传染病的mRNA疫苗。此外,他们找到了强大的合作伙伴 —— 美国默沙东公司,从而把很大一部分精力继续投入到新抗原肿瘤疫苗。在过去一两年中,他们的Ⅱ期临床数据表现非常出色,尤其在黑色素瘤领域。
这两家公司明白新冠疫情已经过去,于是很快将把下一个增长点放在新抗原的mRNA疫苗上。
至于其他疾病的疗法,正如此前说的mRNA作为一种“缺啥补啥”疗法,有很多公司在做,但是短期内尚未看到即将取得突破性进展的迹象。不过总的来说,这个领域的发展必定是未来大家想努力的方向。
05 mRNA技术的未来
问:在业内很多专家看来,mRNA技术可能会给生物医药领域带来巨变,甚至将其称为mRNA医学。您对这个技术未来发展前景有何评价?
徐亦迅:这种前景确实存在,然而我强烈呼吁大家不要对其过度炒作。因为mRNA在疫苗研发上的成功有它的道理。
很多时候,事情恰好发生在特定时间点上。mRNA技术发展受益于新冠病毒的刺激,全球政府迅速投入大量资金,以超快的速度共同应对全人类面临的共同危机。
这也解释了为何这一技术能够在短短一两年内促使卡里科和魏斯曼获得诺贝尔奖,它是有很多特殊原因的。
在正常情况下,许多疾病已经有其他的治疗方法。要推进mRNA作为一种新疗法,必须解决比现有疗法更具优势的问题。然而,如果要在已有疗法的疾病领域成功推动mRNA疗法的发展,就必须克服许多技术上的困难。
06 mRNA药物开发的优势
问:过去,药物的研发周期很长、成本极高,而mRNA药物具有短研发周期的优势,对于这一点,您有何看法?
徐亦迅:研发周期的缩短是相对而言的,因为mRNA具有序列易变的特性。
举例来说,在疫苗领域,这实际上是一个巨大的优势,尤其是针对那些经常发生变异的病毒。你可以随时修改序列以跟上病毒变异的速度。此外,mRNA的生产过程已经非常成熟。

然而,我仍然要提醒大家,临床试验这一阶段通常不是你想快就能快得起来的。它往往是一个“限速”步骤,也就是说,尽管上游的生产和其他过程可以加速,周期可以相对缩短,但要找到一种疾病是否适合这个疗法并不是那么简单。而且一旦找到适用的疾病,需要招募愿意参与临床试验的患者,还要与已有的成熟疗法做头对头的比较,这个过程不容易快起来的。因此,大家不应轻易高估mRNA疗法研发的速度。
07 AI如何助力mRNA药物开发
问:这两年AI很热,并在mRNA序列设计以及验证上有很大的优势。对此,您怎么看?二者的结合能否在未来加速mRNA疫苗药物的开发?
徐亦迅:首先简单评价一下,所谓的AI制药是一个难以精确描述的概念。
我们传统意义上提到的AI主要指深度神经网络,如大家熟知的AlphaGo。2020年出现了AlphaFold,尤其是2021年的AlphaFold2在蛋白质结构预测方面取得了非常了不起的成就。这些能够预测蛋白质结构的AI工具对药物研发确实起到了重要作用,尤其是在分析小分子化合物或抗体与目标蛋白结合时,通过算法分析这些结构的变化可以提供很大的帮助。
此外,还可以利用深度学习筛选小分子药物文库,做虚拟的小分子药物库。一些公司甚至能够根据靶标蛋白的结构设计有机小分子,使其能够与蛋白良好结合。
但是最新的AI技术,比如ChatGPT这类深层次AI,对生物序列可能也有一定的作用,因为它是大型语言模型,而生物序列,无论是DNA、RNA还是蛋白质序列,与人类语言有一定的相似性。因此,使用类似于GPT的算法可能对设计抗体序列或mRNA序列有一定的帮助。
然而,我仍要强调,我们不应过分神化这些工具,也不要对AI制药概念进行夸大炒作。
08 如何坚持科学研究方向?
问:无论是卡里科还是其他诺奖得主,我们可以从他们的科研道路中得到一些启示。例如,如何在困难时期保持执着,不放弃自己的研究方向,如何坚持科研的原创性?
徐亦迅:简而言之,卡里科的职业生涯可以总结为相当曲折,因为她并不完全适应美国生命科学研究的规则。

她幸运地遇到了命中注定的贵人——魏斯曼。如果不是魏斯曼在1997年“救场”,她可能无法继续她热爱的mRNA疗法研究。当然,卡里科本身就是一个非常坚韧不拔的人。在1995年被宾大降职以及40岁时患癌症的双重打击下,她仍决定不放弃对mRNA疗法的研究方向,这种坚持难能可贵。
然而,这种坚持并非适用于所有科学家,因为有时候某些研究方向可能确实会陷入“死胡同”,而保持灵活头脑,转向其他方向未必是坏事。
卡里科是一个个例,由于她在mRNA领域的深厚积累,她对mRNA疗法的信心具有科学依据,这也是她能够与魏斯曼产生共鸣的原因,因为魏斯曼作为新晋助理教授,有很多研究方向可选。如果他没有与卡里科看到相似的研究路径,就不会有如此默契。
本文为科普中国·星空计划扶持
作品团队/作者:深究科学
审核:陶宁 (中国科学院生物物理研究所副研究员)
出品:中国科协科普部
监制:中国科学技术出版社有限公司、北京中科星河文化传媒有限公司








 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国