植物免疫的核心到底是什么?通常我们认为的植物免疫其实就是植物对病虫害等侵扰做出的防御输出。尽管如今植物免疫的理论正不断丰富和完善,比如两条植物免疫途径协同放大免疫输出,亦或者植物免疫反应过程之的某些组分与一系列激素信号等串扰,在另一层面又产生由激素介导的免疫反应,亦或者产生与修饰相关的其它免疫反应等等。但我们认为在现有的植物免疫理论框架下免疫反应的主要反馈是:活性氧迸发,胼胝质积累,钙离子内流,细胞外碱化和防御相关激素表达变化等。
我想来想去,其实植物免疫这一概念描述的还是单一层面的一种状态。比如病原菌落在植物叶片,开始侵染叶片,植物为了抵御病原菌的侵染而发起反攻,比如产生上述所说的那一切。此时此刻或许我们就把植物做出的这一系列反应称之为植物免疫反应。
我记得本科阶段我在中国大学MOOC学习过一门课程,特意去看了一下,这门课程叫《博弈论基础》,浙江大学蒋文华老师主讲。我想了又想,与其站在植物的角度说植物免疫,不如把植物与病原菌之间的这种关系称之为一种博弈。由于这门课程的内容复杂性,我又花了半个小时重温了部分课程内容,好在这门课还可以学习观看。
由于植物与病原菌之间的这种尔虞我诈,明显是一种重复博弈,重复博弈大概有无穷多策略。以囚犯困境为例,植物与病原菌博弈过程中,植物与病原菌得分标准如下:
如果在一次博弈中,植物选择背叛,病原菌也选择背叛,则植物得分0,病原菌得分0;
植物选择背叛,病原菌选择合作,则植物得分-5,病原菌得分5;
植物选择合作,病原菌选择背叛,则植物得分5.病原菌得分-5;
植物选择合作,病原菌也选择合作,则植物得分3,病原菌得分也为3.
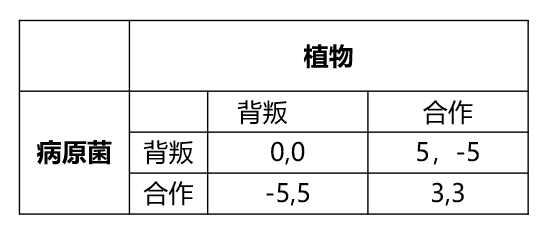
在一次博弈中,虽然看起来合作是最好的一种选择,但实际上最后都会背叛,这便是囚犯困境。卑鄙是卑鄙者的通行证,高尚是高尚者的墓志铭。
植物与病原菌协同进化过程中,显然不是一锤子买卖,而是不知道总共有多少次博弈的重复博弈。在重复博弈过程中,结果或许就不一样了。在《博弈论基础》课程中罗列了重复博弈可选择的几种策略:
- 1雷锋策略:如果一方每次都合作,那对方为了获取最大收益一定每次都选择背叛。
- 2曹操策略:一方每次都背叛,结局就是对方每次也都背叛。
- 3冷酷策略:第一次一方选择合作,对方也选择合作;第二次接着合作;直到有一天发现对方开始背叛,那以后无论对方如何选择,我都选择背叛。
- 4心太软策略:一开始我选择合作,如果对方只是一次背叛,那我选择相信对方,认为这种背叛不是故意的,如果第二次对方选择合作,那我第三次还愿意和对方合作。除非对方连续两次背叛,那就认为对方是故意找茬,在之后的博弈中我就选择背叛到底。
- 5一报还一报策略(Tit for tat):一开始我选择合作,从此以后的每一次博弈我都选择和对方上一次一样的策略。
- 6人鬼策略:总体考虑之前所有的策略,如果在7次博弈中,对方4次合作,3次背叛,那我认为对方仍然还是合作多一些,所以以后我仍然会选择合作。
- 7欺软怕硬策略:如果我背叛对方,对方一点反应没有,那我以后每次博弈都选择欺负对方。如果我背叛对方后,对方选择报复,也背叛我。那我立即在下次博弈中选择合作。
- 8镇定者策略:先建立信任关系,比如在前10次博弈中选择合作,然后再想办法占小便宜。
- 9醉汉策略:随机选择策略,比如抛硬币选择每一次的策略,即没有章法没有规律,也就是不知好歹。如果对方是醉汉策略,那曹操策略就是对付醉汉策略的最优策略。
植物与病原菌的不知博弈次数的重复博弈中,植物和病原菌各位为了自身利益最大化,它们会如何选择博弈策略呢?那就只有植物和病原菌分别用所有的策略试一下,也就是两两策略之间博弈。最后通过打分评判哪种策略在博弈中可得最高分。
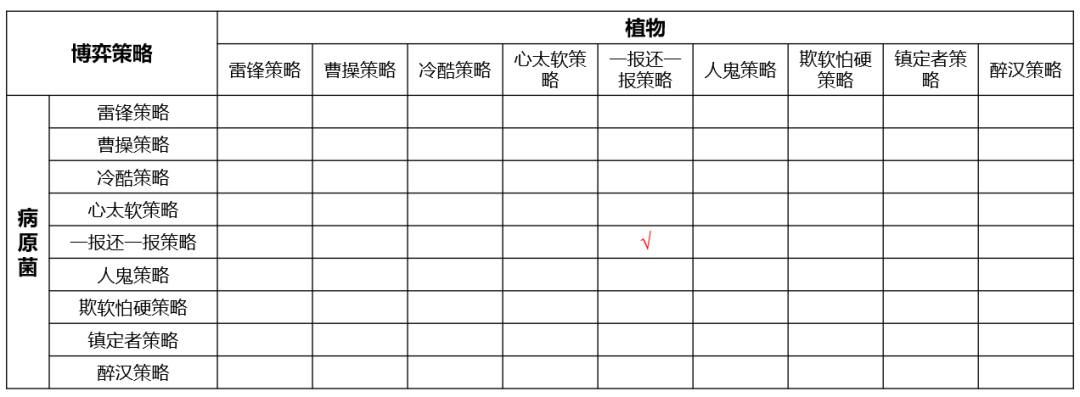
还真有人做过这个试验,每两种博弈,最后一报还一报得分最高。在植物与病原菌博弈过程中,显然是病原菌背叛植物,植物想办法背叛病原菌的无限循环。
真菌与植物 | 一报还一报重复博弈
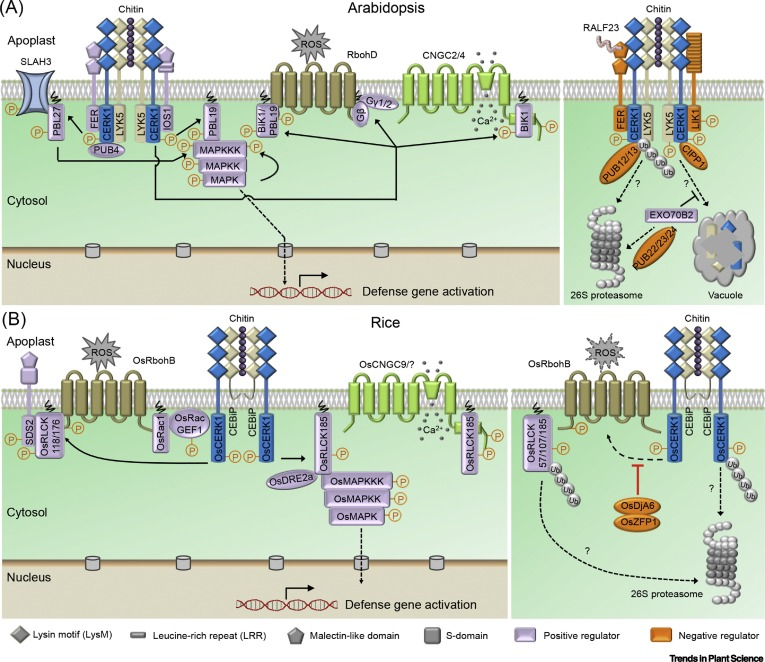
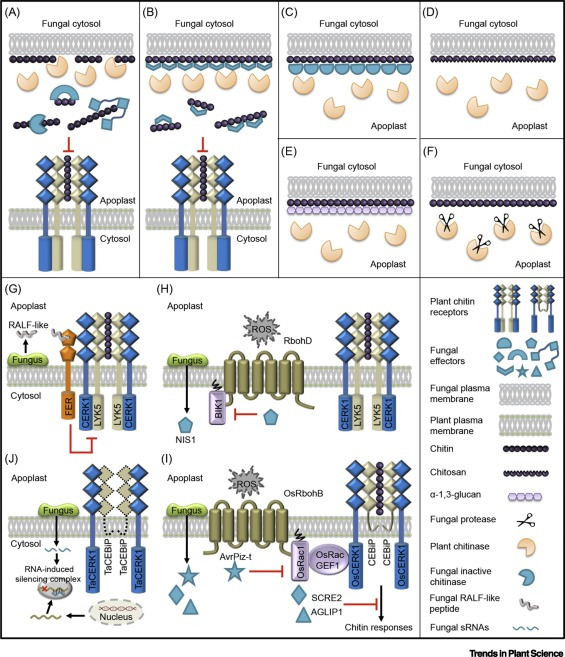
真菌侵染植物后,为了在生长和侵染植物过程中保持细胞壁的可塑性,利用几丁质酶重塑其聚合几丁质,从而释放几丁质,植物为抵御病原菌的侵染,由植物含LysM基序的类受体激酶识别几丁质以介导植物免疫,同时,当植物细胞感知到真菌病原体侵染时,也会向质外体分泌几丁质酶来消化真菌细胞壁中的几丁质。下面就围绕这一主题概述、整理植物与病原菌之间的重复博弈。
真菌细胞壁几丁质与植物之间的一报还一报博弈
1997年,Ito Yuki等人在Plant J发表题为“Identification of a high-affinity binding protein for N-acetylchitooligosaccharide elicitor in the plasma membrane of suspension-cultured rice cells by affinity labeling”的文章,通过光亲和标记和亲和交联试验明确,Chitin (C8H13O5N)n能够特异性抑制75KD蛋白的标记,而高浓度chito-octaose (GlcN)8, cellopentaose 和alpha-1,4 linked N-acetylgalactosamine octamer (GalNAc)8都不能抑制75KD蛋白的标记。基本认定这个75kDa的蛋白质代表了Chitin (C8H13O5N)n的受体。
2001年,N. Shibuya等人在Physiol. Mol. Plant Pathol.发表题为“Oligosaccharide signalling for defence responses in plant”的文章,壳寡糖(N-乙酰壳寡糖)是一种代表性的一般诱导子,在包括单子叶植物和双子叶植物在内的多种植物细胞中诱导防御反应(Ito et al., 1997)。
2006年,Hanae Kaku等人在PANS发表题为“Plant cells recognize chitin fragments for defense signaling through a plasma membrane receptor”的文章,他们从悬浮培养的水稻细胞质膜上分离出一种与Chitin具有高亲和力的结合蛋白(chitin oligosaccharide elicitor-binding protein,CEBiP)。通过RNA干扰敲除CEBiP基因,抑制了诱导子诱导的氧化爆发等反应,表明CEBiP在水稻细胞对几丁质寡糖诱导子的感知和转导中起着关键作用。结构分析表明CEBiP胞外区存在2个LysM基序,C末端具有一个跨膜结构域(Kaku et al., 2006)。
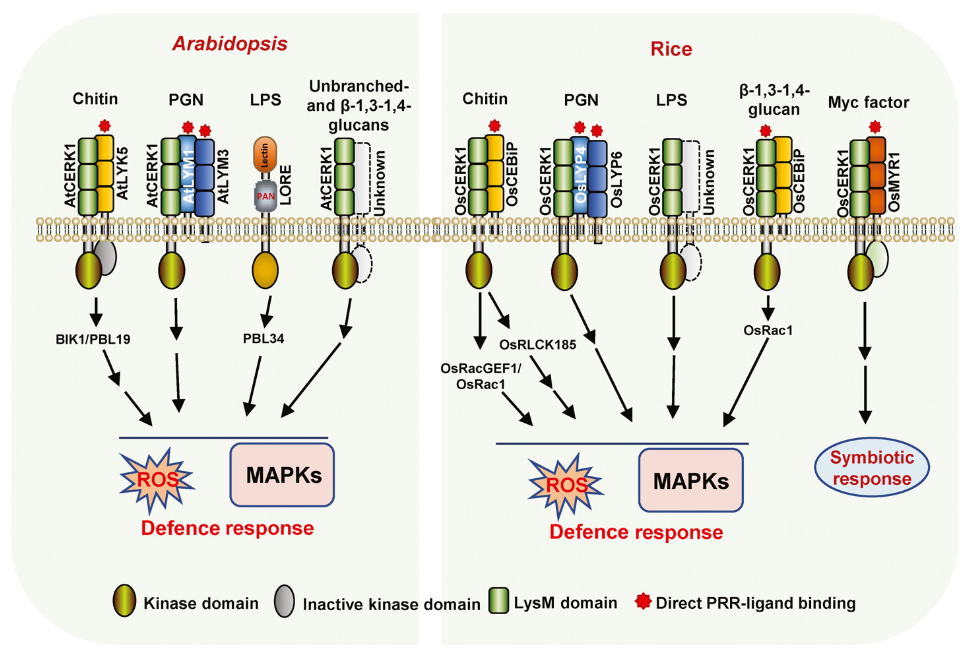
2007年,Ayako Miya等人在PNAS发表题为“CERK1, a LysM receptor kinase, is essential for chitin elicitor signaling in Arabidopsis”的文章。他们在之前的研究中发现水稻中感知Chitin的受体CEBiP介导植物先天免疫,而CEBiP的结构分析不包含任何细胞内结构域,这表明细胞外信号向胞内传导需要额外的组分。于是他们选择了一系列具有胞外LysM基序的拟南芥突变体,鉴定到其中一个类受体激酶的KO突变体完全失去了对几丁质诱导子的反应能力,包括MAPK活化、活性氧的产生和基因表达。KO突变体对不亲和真菌油菜链格孢的抗病性部分受损。这个类受体激酶就是CERK1(chitin elicitor receptor kinase 1,At3g21630)。CERK1蛋白的结构预测表明,其胞外含有3个LysM基序,一个单次跨膜结构域和一个胞内激酶结构域(Miya et al., 2007)。
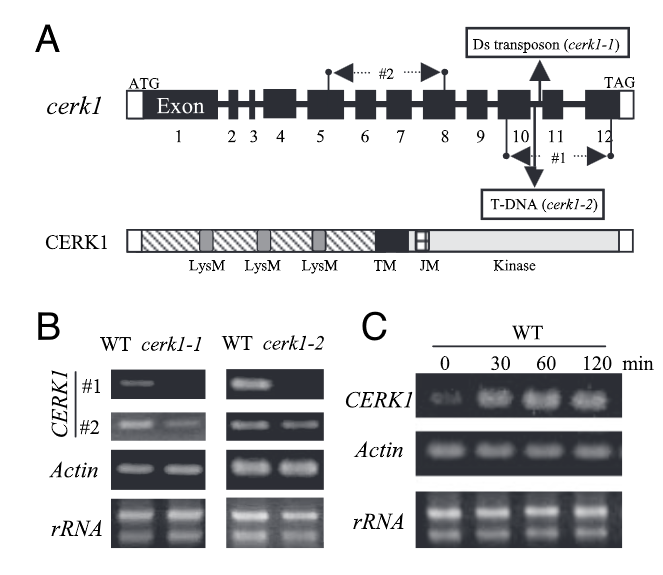
2008年,Jinrong Wan等人在the Plant cell发表题为“A LysM Receptor-Like Kinase Plays a Critical Role in Chitin Signaling and Fungal Resistance in Arabidopsis”的文章,他们同样为了鉴定拟南芥中LysM-RLK在感知Chitin信号传导中的作用,创制了拟南芥中所有5个LysM-RLK基因(即At1g51940、At2g23770、At2g33580、At3g01840和At3g21630)。用纯化的Chitin处理纯合突变体,并检测防御标志基因的表达。只有一个对应于At3g21630(LysM-RLK1)的突变体似乎完全阻断了所选CRG的诱导,而其他四个LysM-RLK基因的突变对CRG的表达没有明显影响。其实这个LysM-RLK1就是CERK1(Wan et al., 2008)。
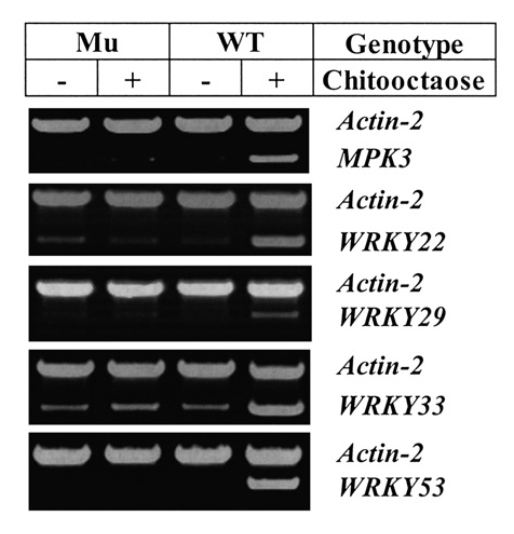
趋同性或许无处不在,拟南芥和水稻对Chitin的感知亦如此。上述的研究首先了OsCEBiP感知Chitin后介导植物免疫反应,而拟南芥中CERK1突变体几乎断绝了由Chitin触发的植物免疫。尚不清楚每种植物是否都需要这两种类型的分子来进行几丁质信号传导,也不知道这些分子在膜信号传导中的关系。那拟南芥中的几丁质受体系统是否也需要类似于水稻几丁质受体的CEBiP样结合蛋白。结果出乎意料地表明,拟南芥中的几丁质受体系统与水稻中的明显不同。在拟南芥中,几丁质信号传导不需要CEBiP样分子,而AtCERK1本身似乎足以进行几丁质感知/信号传导,尽管拟南芥的CEBiP同源物在生物化学上完全具有几丁质结合蛋白的功能。对At/OsCERK1的几丁质结合特性和由这些分子的EDs/胞质结构域组成的嵌合受体的研究表明,它们的EDs特性的差异导致了这种差异,即这些植物中几丁质信号的“一体式”或多组分受体。
2010年,Takeo Shimizu等人在the Plant J发表题为“Two LysM receptor molecules, CEBiP and OsCERK1, cooperatively regulate chitin elicitor signaling in rice”的文章,表明两个LysM受体分子CEBiP和OsCERK1协同调节水稻几丁质诱导子信号传导。他们通过搜索水稻数据库,共发现10个OsLysM-RLK基因,其中OsLysM-RLK9(OsCERK1)与AtCERK1具有54%氨基酸序列同一性。OsCERK1受Chitin诱导上调表达。OsCERK1由624个氨基酸残基组成,包含信号肽,仅含1个LysM基序的胞外配体结合结构域,单次跨膜结构域和一个胞内激酶结构域。OsCERK1仅有的一个LysM基序与AtCERK1的第三个LysM3基序具有54.8%的序列相似性。此外,OsCERK1与AtCERK1的胞内激酶结构域具有64%的序列相似性,但这一点我认为在如此庞大且保守的激酶结构域中不足为奇。需要注意的时,酵母双杂交分析结果表明,OsCEBiP和OsCERK1都具有形成异源或同源低聚物的潜力。Chitin能够诱导OsCEBiP和OsCERK1形成异源二聚体受体复合物,而没有Chitin时,OsCEBiP主要以同源二聚体的形式存在(Shimizu et al., 2010)。
2014年,Masahiro Hayafune等人在PNAS发表题为“Chitin-induced activation of immune signaling by the rice receptor CEBiP relies on a unique sandwich-type dimerization”的文章。阐明了水稻PRR、OsCEBiP特异性识别Chitin低聚糖的分子基础,以及受体复合物的形成和激活。OsCEBiP外结构域中的中心LysM基序对Chitin的结合至关重要。通过NMR光谱进行的表位定位表明,长链几丁质低聚糖(如七聚体-八聚体)优先结合OsCEBiP,以及N-乙酰基对结合的重要性。分子建模/对接研究阐明了CEBiP和几丁质寡糖之间的分子相互作用,并表明Ile122在赖氨酸中心基序区对配体结合的重要性。基于这些结果,表明两个CEBiP分子同时与另一侧的一个几丁质寡糖结合,导致CEBiP的二聚化(Hayafune et al., 2014)。
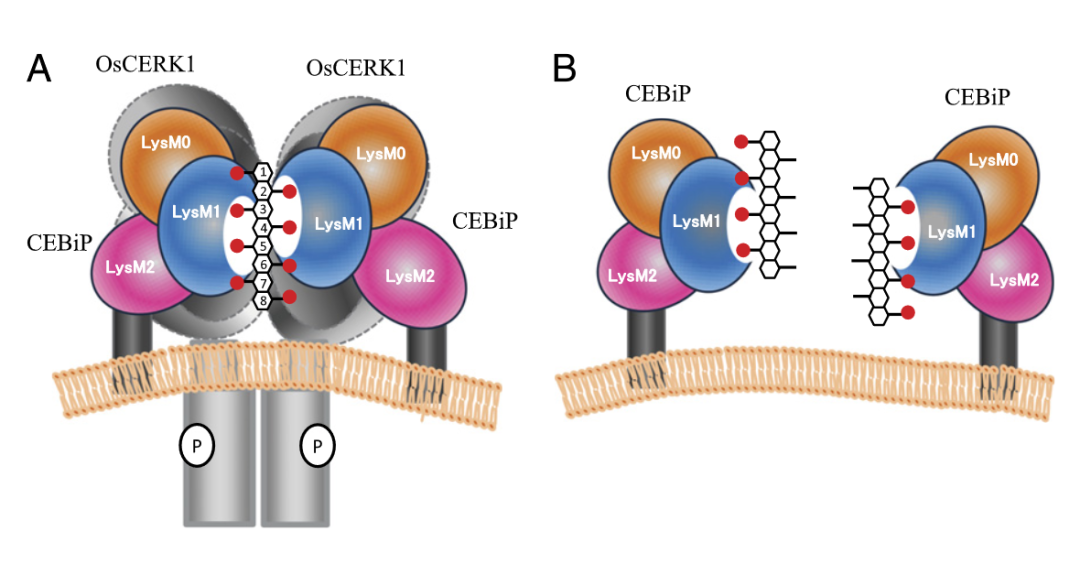
此前,通过使用酵母双杂交分析表明,OsCEBiP的胞外域可以与OsCERK1的胞外区相互作用。此外,观察到OsCERK1的一部分与CEBiP共免疫沉淀,即使在不存在(GlcNAc)8的情况下也是如此。尽管共免疫沉淀的OsCERK1的量随着(GlcNAc)8的加入而增加,但这些结果表明,即使在没有几丁质寡糖的情况下,CEBiP和OsCERK1至少有一部分在质膜上相互作用,可能是通过它们的外结构域的相互作用。总的来说,OsCEBiP形成结合长链Chitin的同源二聚体,并招募两个OsCERK1形成异源复合物。
至此,水稻CEBiP作为几丁质直接受体,OsCERK1作为CEBiP适配器(共受体)的假说得以证实。但并没有明确OsCERK1与Chitin之间有无直接互作关系。
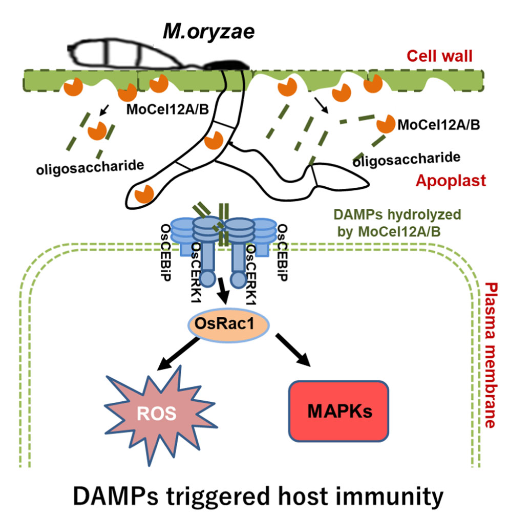
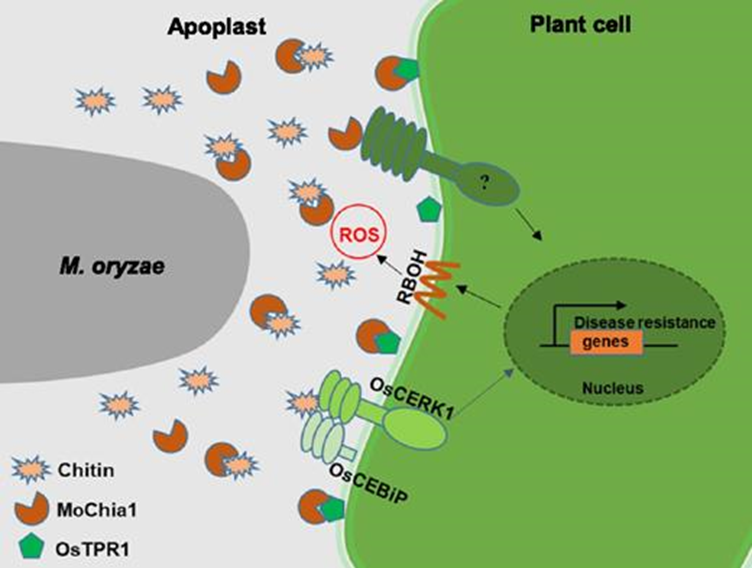
2021年,Chao Yang等人在Nature Communications发表题为“Poaceae-specific cell wall-derived oligosaccharides activate plant immunity via OsCERK1 during Magnaporthe oryzae infection in rice”的文章。许多植物病原体分泌细胞壁降解酶(CWDE)来损伤宿主细胞并促进定植。纤维素和半纤维素作为植物细胞壁的主要成分,是CWDE的靶标。受损的植物细胞通常会释放损伤相关分子模式(DAMP)来触发植物免疫反应。在这里,我们确定真菌病原体稻瘟病菌在水稻(Oryza sativa)感染期间分泌内切葡聚糖酶MoCel12A和MoCel12B。这些内切葡聚糖酶靶向水稻细胞壁的半纤维素,并释放两种特定的低聚糖,即三糖31-β-D-纤维素二糖基葡萄糖和四糖31-α-D-纤维素三糖基葡萄糖。31-β-D-纤维素酶-葡萄糖和31-β-D纤维素酶-葡萄糖结合免疫受体OsCERK1,但不结合几丁质结合蛋白OsCEBiP。然而,它们诱导OsCERK1和OsCEBiP的二聚化。此外,这些禾本科植物细胞壁特异性低聚糖触发活性氧(ROS)的爆发,而活性氧在oscerk1和oscebip突变体中很大程度上受到损害。我们得出结论,31-β-D-纤维素酶-葡萄糖和31-β-D纤维素酶-葡萄糖是从水稻细胞壁半纤维素释放的特异性DAMP,在水稻米曲霉感染过程中,OsCERK1和OsCEBiP免疫复合物可以感知到这些DAMP(Yang et al., 2021)。
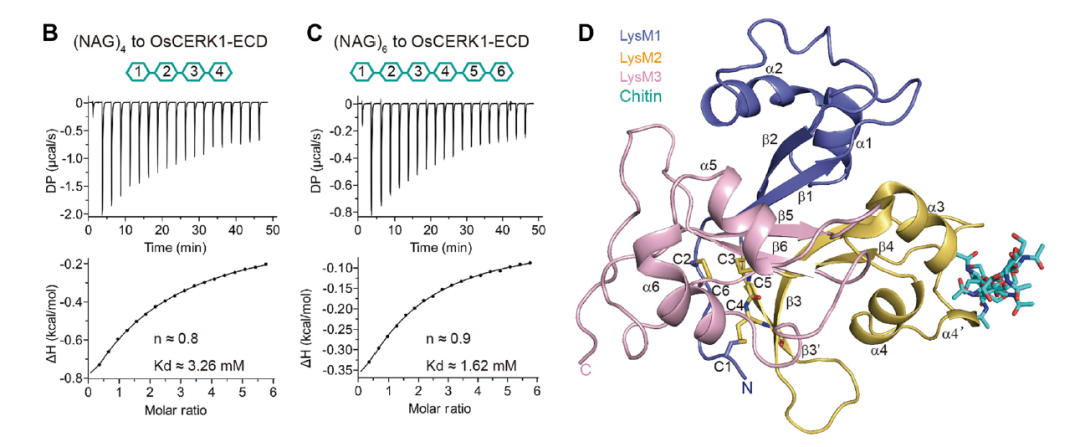
2022年,Li Xu等人在Journal of Integrative Plant Biology 发表题为“Structural insight into chitin perception by chitin elicitor receptor kinase 1 of Oryza sativa”的文章。解析了OsCERK1-(NAG)6的复合物结构,揭示了OsCERK1直接识别几丁质的分子机理(Xu et al., 2023)。
那在拟南芥中的情况如何?
2010年,Elena K. Petutschnig等人在JBC发表题为“The Lysin Motif Receptor-like Kinase (LysM-RLK) CERK1 Is a Major Chitin-binding Protein in Arabidopsis thaliana and Subject to Chitin-induced Phosphorylation”的文章,他们的研究均表明AtCERK1可以直接识别Chitin(Petutschnig et al., 2010)。
2010年,Ei’ichi Iizasa等人在JBC发表题为“Direct Binding of a Plant LysM Receptor-like Kinase, LysM RLK1/CERK1, to Chitin in Vitro*”的文章,他们的研究均表明AtCERK1可以直接识别Chitin(Iizasa et al., 2010)。
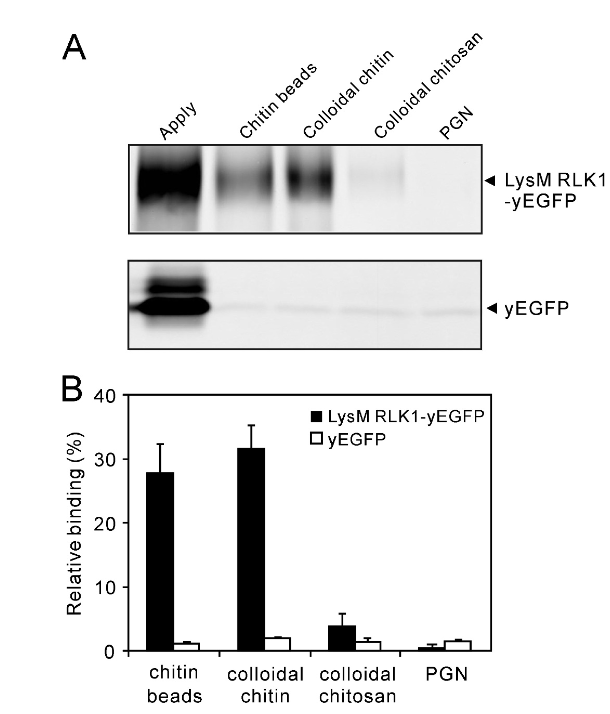
2012年,Tomonori Shinya等人在Plant and Cell Physiology发表题为“Functional Characterization of CEBiP and CERK1 Homologs in Arabidopsis and Rice Reveals the Presence of Different Chitin Receptor Systems in Plants”的文章。指出OsCERK1不与Chitin结合(Shinya et al., 2012)。
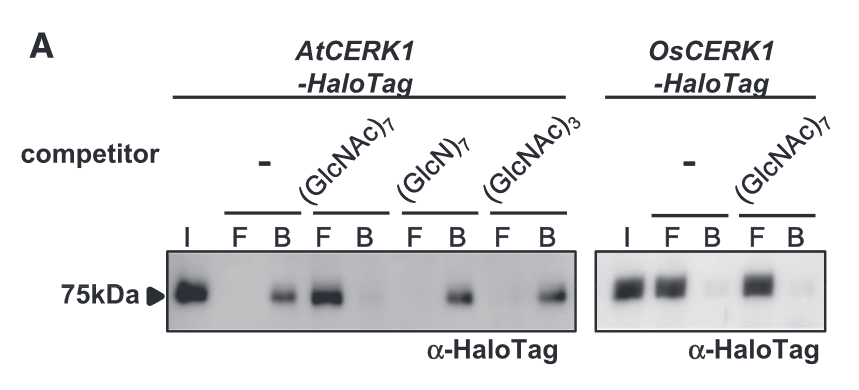
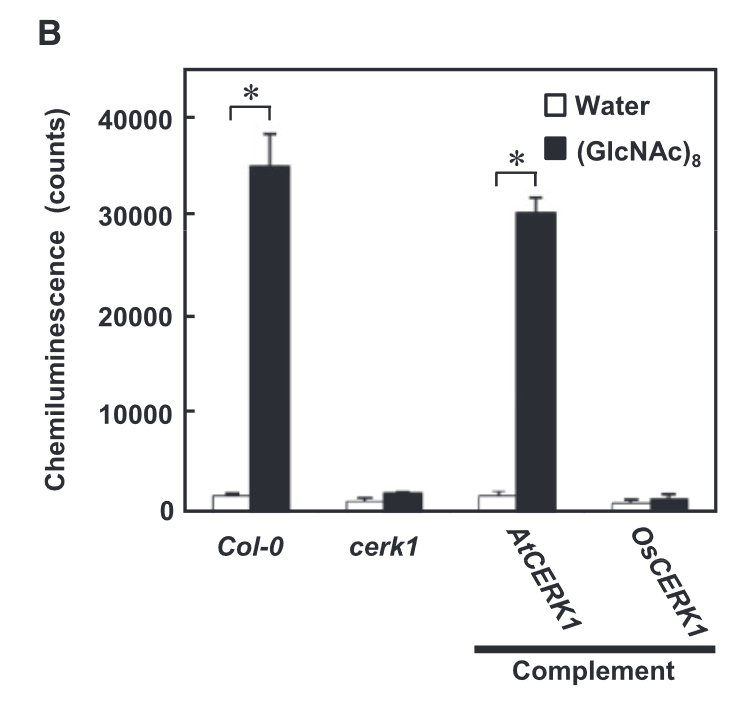
2012年,TINGTING LIU等人在Science发表题为“Chitin-Induced Dimerization Activates a Plant Immune Receptor”的文章,他们的研究解析了AtCERK1 的晶体结构。并表明AtCERK1通过其胞外含有LysM基序的结构域直接结合Chitin,从而激活植物免疫。几丁质诱导的 AtCERK1 二聚化对其激活至关重要。似乎这篇Science就要对拟南芥中Chitin的受体是AtCERK1盖棺定论了。需要注意,AtCERK1对几丁质的结合常数(Kd = 45 μM)(Liu et al., 2012)。
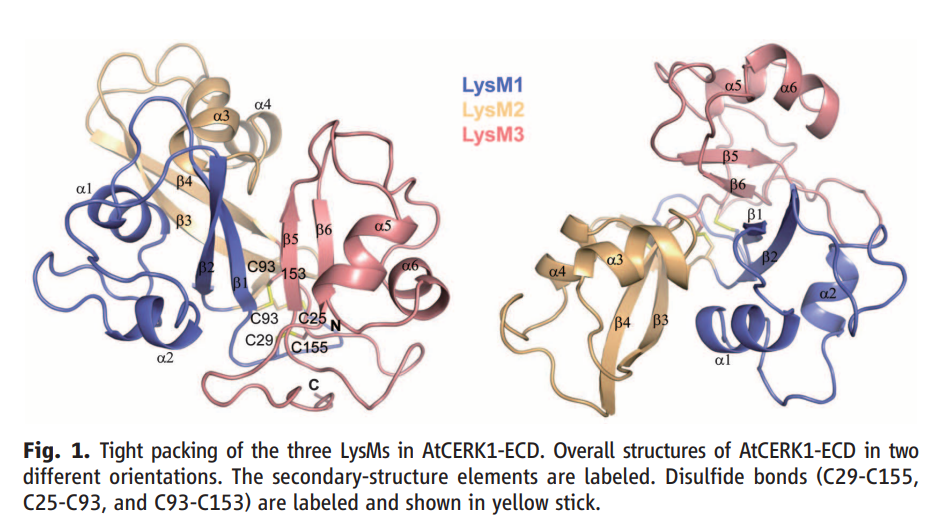
2012年,Jinrong Wan等人在Plant Physiology发表题为“LYK4, a Lysin Motif Receptor-Like Kinase, Is Important for Chitin Signaling and Plant Innate Immunity in Arabidopsis”的文章,他们将拟南芥中的3个CEBiP同源基因分别敲除或组合敲除,均不影响拟南芥对Chitin的感知。所以该团队考虑是否其它LysM-RLK也参与Chitin的感知。于是重新聚焦他们在2008年考虑过的拟南芥中5个编码LysM-RLK的蛋白(LYK1,LYK2,LYK3,LYK4,LYK5),其中LYK1即CERK1,对其它四个LYKs分别敲除后发现只有LYK4的敲除突变体影响拟南芥对Chitin的感知,而LYK2、LYK3和LYK5的单敲和三敲突变体均对Chitin的感知没有显著影响。总的来说,LYK4也参与识别Chitin后触发拟南芥对DC3000等的抗性,尽管表型没有LYK1/CERK1那么显著。因此LYK4可能在Chitin识别受体复合物中发挥作用,协助Chitin信号传导和植物先天免疫(Wan et al., 2012)。
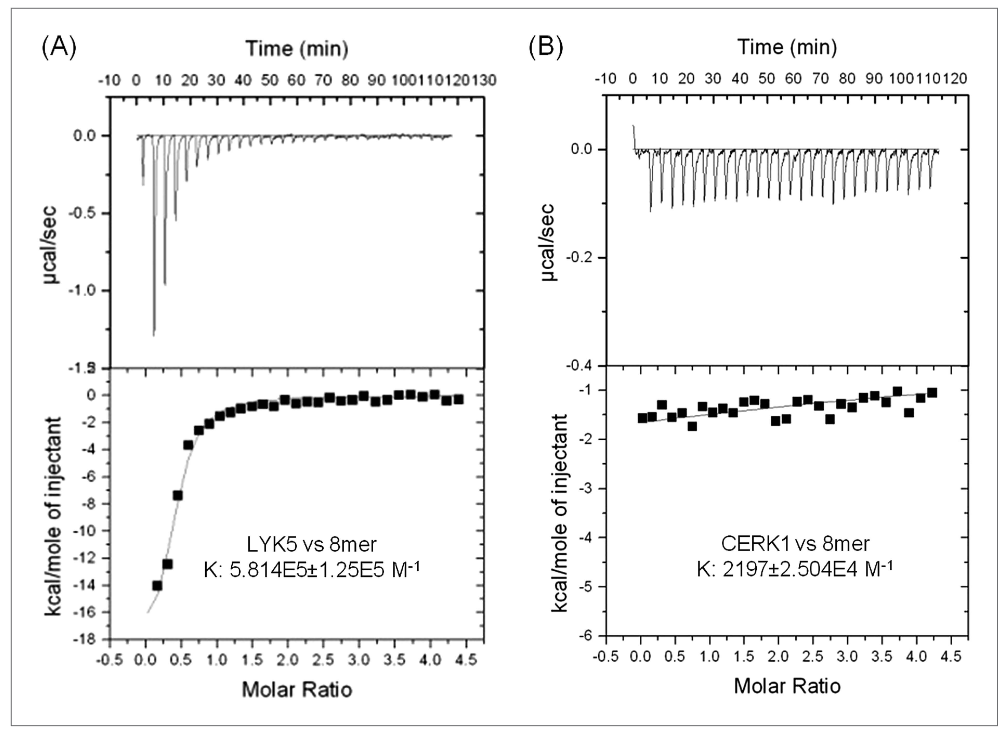
2014年,Yangrong Cao等人在eLife发表题为“The kinase LYK5 is a major chitin receptor in Arabidopsis and forms a chitin-induced complex with related kinase CERK1”的文章。先前的研究表明,AtCERK1是主要的几丁质受体,通过同源二聚化和磷酸化介导几丁质诱导的信号传导。然而,报道的AtCERK1的几丁质结合亲和力相当低,这表明可能存在另一种具有高几丁质结合亲和性的受体。在这里,我们提出AtLYK5是拟南芥中的主要几丁质受体。AtLYK5的突变导致几丁质反应的显著降低。然而,AtLYK5与AtLYK4具有重叠的功能,因此,AtLYK4/AtLYK5-2双突变体显示出几丁质反应的完全丧失。AtLYK5以几丁质依赖的方式与AtCERK1相互作用。几丁质与AtLYK5的结合对于几丁质诱导的AtCERK1磷酸化是必不可少的。AtLYK5以比AtCERK1高得多的亲和力结合几丁质。这些数据表明,AtLYK5是几丁质的主要受体,与AtCERK1形成几丁质诱导复合物以诱导植物免疫(Cao et al., 2014)。
2020年,Zoltan Bozsoki等人在Science发表题为“Ligand-recognizing motifs in plant LysM receptors are major determinants of specificity”的文章。植物进化赖氨酸基序(LysM)受体来识别和解析微生物激发子,并驱动细胞内信号传导以限制或促进微生物定殖。这里研究了Lotus japonicus的几丁质和结瘤因子受体如何启动免疫或根瘤共生的差异信号传导。这些受体的LysM1结构域中的两个基序决定了配体的特异性识别,并区分了它们在植物中的功能。这些基序定义了配体结合位点,并构成同源Nod因子受体中结构差异最大的区域。相邻基序调节Nod因子识别的特异性,并决定豆类中兼容根瘤共生体的选择。我们还确定了LysM受体的结合特异性是如何改变的,以促进来自几丁质受体的Nod因子识别和信号传导,从而推进了将根瘤共生体工程化为非豆科植物的前景(Bozsoki et al., 2020)。
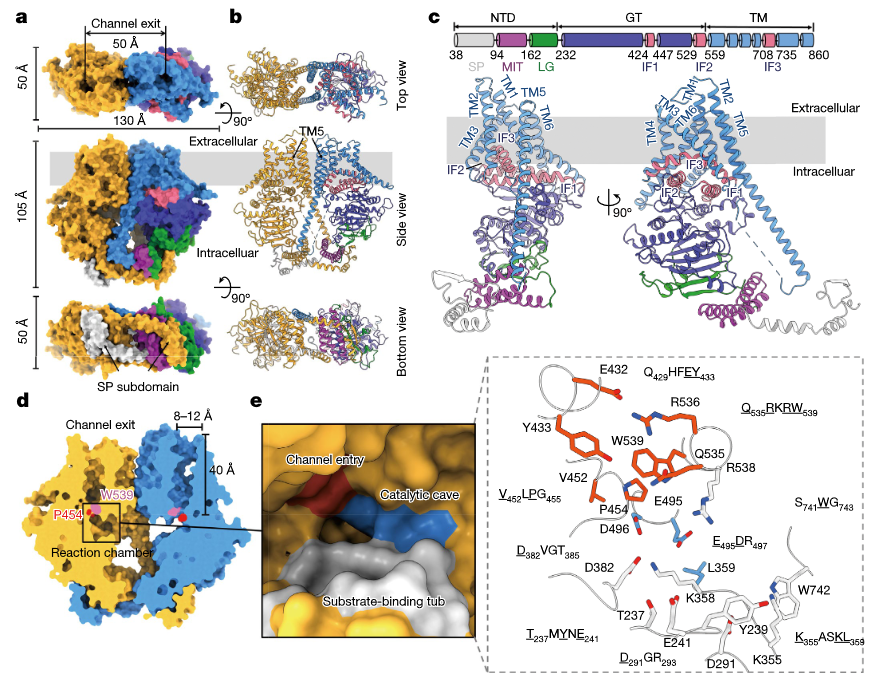
2022年,Wei Chen等人在Nature发表了题为“Structural basis for directional chitin biosynthesis”的文章,解析了大豆疫霉几丁质合成酶PsChs1的晶体结构(Chen et al., 2022)。
重复博弈
关于拟南芥和水稻中Chitin的受体,到目前为止,基本清晰。我们默认病原菌细胞壁成分Chitin的出现是对植物的一次背叛博弈,那植物中一些PRRs(AtCERK1,AtLYK5,OsCERK1,OSCEBiP等)感知Chitin,当然认为也是一种背叛博弈的报复。但植物与病原菌之间的关系绝不仅此。
2019年,Li-Bo Han等人在the Plant cell发表题为“The Cotton Apoplastic Protein CRR1 Stabilizes Chitinase 28 to Facilitate Defense against the Fungal Pathogen Verticillium dahliae”的文章,棉花细胞分泌几丁质酶 28 (Chi28) 来消化大丽轮枝菌中的几丁质,大丽轮枝菌为了抑制几丁质的降解,会分泌 Ser 蛋白酶 1 (VdSSEP1) 来水解 Chi28,而 Chi28 受到棉花富含 Cys 的重复蛋白 1 (CRR1) 的保护和稳定。为了对抗几丁质引发的免疫,大丽轮枝菌还分泌多糖脱乙酰酶1(PDA1)来直接对几丁质低聚物进行脱乙酰化。
2019年,Yijuan Han等人在Plant Physiology发表题为“A Magnaporthe Chitinase Interacts with a Rice Jacalin-Related Lectin to Promote Host Colonization”的文章。他们表征了稻瘟病菌几丁质酶MoChi1的功能,以及它与水稻中的蛋白OsMBL1(一种与jacalin相关的甘露糖结合凝集素(MBL))的相互作用。MoChi1的敲除导致稻瘟病菌气生菌丝形成减少,毒力降低。在体外和体内证实了MoChi1与水稻OsMBL1的相互作用。OsMBL1由病原体相关分子模式和稻瘟病菌感染诱导OsMBL1的过表达导致水稻防御反应基因的激活和几丁质诱导的活性氧爆发,从而增强对稻瘟病的抗性。敲除OsMBL1增强了水稻对稻瘟病的易感性。此外,MoChi1抑制了几丁质诱导的水稻细胞中的活性氧,并与OsMBL1竞争几丁质结合。
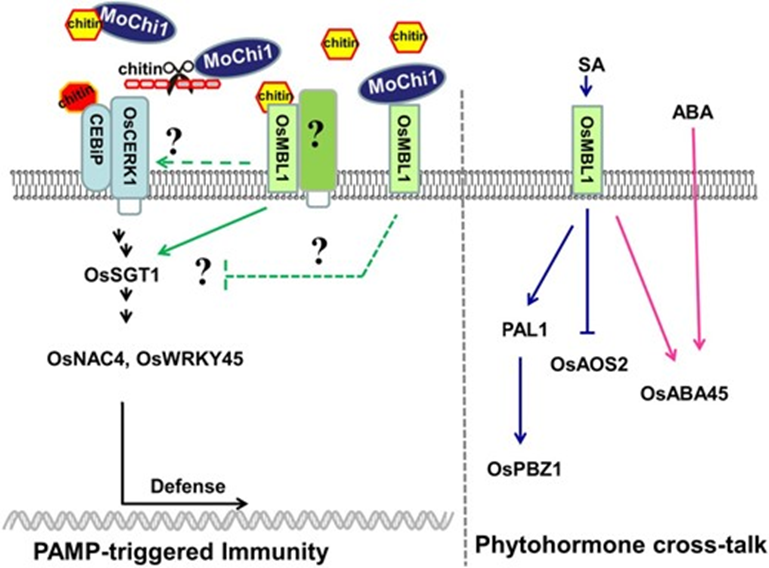
2019年,Chao Yang等人在The Plant Cell发表题为“Binding of the Magnaporthe oryzae Chitinase MoChia1 by a Rice Tetratricopeptide Repeat Protein Allows Free Chitin to Trigger Immune Responses”的文章。稻瘟病菌几丁质酶 MoChia1 通过优先与几丁质结合而削弱水稻 PRR 感知几丁质介导的植物免疫,而水稻四肽重复蛋白 OsTPR1 竞争性地结合 MoChia1,企图重新释放由MoChia1结合的几丁质,以重新激活植物免疫。
近年来,关于Chitin与植物之间的重复博弈还在进行中。最近的几篇综述或可对上述植物与病原菌之间重复博弈的过程进行总结和展望。
参考文献
Bozsoki, Z., Gysel, K., Hansen, S. B., Lironi, D., Krönauer, C., Feng, F., de Jong, N., Vinther, M., Kamble, M., Thygesen, M. B., et al. (2020). Ligand-recognizing motifs in plant LysM receptors are major determinants of specificity. Science 369:663–670.
Cao, Y., Liang, Y., Tanaka, K., Nguyen, C. T., Jedrzejczak, R. P., Joachimiak, A., and Stacey, G. (2014). The kinase LYK5 is a major chitin receptor in Arabidopsis and forms a chitin-induced complex with related kinase CERK1. Elife 3:e03766.
Chen, W., Cao, P., Liu, Y., Yu, A., Wang, D., Chen, L., Sundarraj, R., Yuchi, Z., Gong, Y., Merzendorfer, H., et al. (2022). Structural basis for directional chitin biosynthesis. Nature 610:402–408.
Gong, B.-Q., Wang, F.-Z., and Li, J.-F. (2020). Hide-and-Seek: Chitin-Triggered Plant Immunity and Fungal Counterstrategies. Trends in Plant Science 25:805–816.
Hayafune, M., Berisio, R., Marchetti, R., Silipo, A., Kayama, M., Desaki, Y., Arima, S., Squeglia, F., Ruggiero, A., Tokuyasu, K., et al. (2014). Chitin-induced activation of immune signaling by the rice receptor CEBiP relies on a unique sandwich-type dimerization. Proceedings of the National Academy of Sciences 111:E404–E413.
Iizasa, E., Mitsutomi, M., and Nagano, Y. (2010). Direct binding of a plant LysM receptor-like kinase, LysM RLK1/CERK1, to chitin in vitro. J Biol Chem 285:2996–3004.
Ito, Y., Kaku, H., and Shibuya, N. (1997). Identification of a high-affinity binding protein for N-acetylchitooligosaccharide elicitor in the plasma membrane of suspension-cultured rice cells by affinity labeling. Plant J 12:347–356.
Kaku, H., Nishizawa, Y., Ishii-Minami, N., Akimoto-Tomiyama, C., Dohmae, N., Takio, K., Minami, E., and Shibuya, N. (2006). Plant cells recognize chitin fragments for defense signaling through a plasma membrane receptor. Proceedings of the National Academy of Sciences 103:11086–11091.
Liu, T., Liu, Z., Song, C., Hu, Y., Han, Z., She, J., Fan, F., Wang, J., Jin, C., Chang, J., et al. (2012). Chitin-Induced Dimerization Activates a Plant Immune Receptor. Science 336:1160–1164.
Miya, A., Albert, P., Shinya, T., Desaki, Y., Ichimura, K., Shirasu, K., Narusaka, Y., Kawakami, N., Kaku, H., and Shibuya, N. (2007). CERK1, a LysM receptor kinase, is essential for chitin elicitor signaling in Arabidopsis. PNAS 104:19613–19618.
Petutschnig, E. K., Jones, A. M. E., Serazetdinova, L., Lipka, U., and Lipka, V. (2010). The Lysin Motif Receptor-like Kinase (LysM-RLK) CERK1 Is a Major Chitin-binding Protein in Arabidopsis thaliana and Subject to Chitin-induced Phosphorylation*♦. Journal of Biological Chemistry 285:28902–28911.
Shimizu, T., Nakano, T., Takamizawa, D., Desaki, Y., Ishii-Minami, N., Nishizawa, Y., Minami, E., Okada, K., Yamane, H., Kaku, H., et al. (2010). Two LysM receptor molecules, CEBiP and OsCERK1, cooperatively regulate chitin elicitor signaling in rice. The Plant Journal 64:204–214.
Shinya, T., Motoyama, N., Ikeda, A., Wada, M., Kamiya, K., Hayafune, M., Kaku, H., and Shibuya, N. (2012). Functional Characterization of CEBiP and CERK1 Homologs in Arabidopsis and Rice Reveals the Presence of Different Chitin Receptor Systems in Plants. Plant and Cell Physiology 53:1696–1706.
Wan, J., Zhang, X.-C., Neece, D., Ramonell, K. M., Clough, S., Kim, S.-Y., Stacey, M. G., and Stacey, G. (2008). A LysM receptor-like kinase plays a critical role in chitin signaling and fungal resistance in Arabidopsis. Plant Cell 20:471–481.
Wan, J., Tanaka, K., Zhang, X.-C., Son, G. H., Brechenmacher, L., Nguyen, T. H. N., and Stacey, G. (2012). LYK4, a Lysin Motif Receptor-Like Kinase, Is Important for Chitin Signaling and Plant Innate Immunity in Arabidopsis. Plant Physiology 160:396–406.
Xu, L., Wang, J., Xiao, Y., Han, Z., and Chai, J. (2023). Structural insight into chitin perception by chitin elicitor receptor kinase 1 of Oryza sativa. Journal of Integrative Plant Biology 65:235–248.
Yang, C., Liu, R., Pang, J., Ren, B., Zhou, H., Wang, G., Wang, E., and Liu, J. (2021). Poaceae-specific cell wall-derived oligosaccharides activate plant immunity via OsCERK1 during Magnaporthe oryzae infection in rice. Nat Commun 12:2178.
Yang, C., Wang, E., and Liu, J. (2022). CERK1, more than a co-receptor in plant–microbe interactions. New Phytologist 234:1606–1613.




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国