原子如何彼此连接形成分子,是物质结构研究中面临的首要问题。化学键理论的建立和进化,记录了几代化学家前赴后继探索微观世界奥秘的历程,是见证现代化学发展的一场多幕剧。
注:本文方框中的技术细节部分,非专业读者可以略过,不影响整体理解。
撰文 | 郑超(中国科学院上海有机化学研究所研究员)
大自然像极了双面的斯芬克斯:她一面固执地拒绝每一个试图闯入她秘境的笨拙之举;一面敞开双臂,毫无保留地接纳读懂了万物真谛的睿智探索者。
—— R. S. Mulliken
世界的本质是什么?我们应当如何认识世界?面对这样的终极哲学拷问,古代东西方的先贤智者无不把解答的希望寄托于暂时还无法企及的微观境界。“一尺之棰,日取其半,万世不竭”,《庄子·天下》中的寥寥数语蕴含着物质无限可分的朴素思想。与之相反,《墨子·经说下》则说“无与非半,不可斫也”,意即这种连续取半的操作总会有无法进行下去的时候。几乎在同时代,古希腊自然派哲学家德谟克利特(Democritus)认为,对物质的分割存在明确的终点:原子(atom)。世间万物都是由原子组成,自然界每一件事的发生都能在原子中找到本因。
原子从哲学思辨发展为科学概念经历了漫长的两千多年。十九世纪初,道尔顿(J. Dalton)提出了近代科学意义上的原子理论:每种元素都对应一种特定性质且不可分割的原子,不同种类的原子可以按照简单的整数比相互结合。阿伏伽德罗(A. Avogadro)进一步指出,这种结合的结果是形成分子(molecule),而分子正是保持物质化学性质的最小单元。见微方能知著,从研究分子结构入手探索物质的性质和演化规律是物理学家和化学家共同肩负的使命。然而这条道路异常的曲折坎坷。原子和分子是如此微小,以至于在缺乏直接观测手段的年代,它们的实在性始终存疑。更为困难的问题是,原子究竟依靠了怎样的“亲和力”才彼此连接、聚沙成塔,构成了种类繁多、千变万化的分子?
1897年,汤姆逊(J. J. Thomson)在阴极射线中发现了电子;1911年,卢瑟福(E. Rutherford)从α粒子散射实验中推断出原子核的存在。人类终于叩开了微观世界的大门。二十世纪的前三十年见证了自牛顿以来最伟大的科学革命,量子力学精妙的方程已然揭示了原子、分子相互作用所必须遵循的全部规律。但是这并不意味着物质结构和化学反应可以被完全转化为数学问题并精确求解,因为求解这些方程所需要的巨量计算与纷繁复杂的分子结构之间构成了一对难以调和的矛盾。化学家们需要在单一的还原论逻辑之外别图良策,建立一种既相容于量子力学基本原理、又能回避繁琐数学计算的思维工具,用便于人类理解的方式为分子世界的运动立法。“化学键”理论的形成和进化就是在这条道路上上演的一场多幕剧,是一百多年来几代化学家的深刻洞见与创造性思维的结晶。
铁画银钩 | 点、线和箭头组成的图案
19世纪50年代,有机化学家已经普遍接受了原子、分子的观念。1852年弗兰克兰(E. Frankland)在研究有机锌试剂时首先提出“键(bond)”的概念,用来描述两个原子之间的连接。随后,以凯库勒(F. A. Kekulé)、库珀(A. S. Couper)、布特列洛夫(A. Butlerov)为代表的一批化学家利用化学键的概念,构建了有机化学的基本理论。根据当时已有的电化学知识,原子间的连接被认为源于正负电荷的相互吸引;在汤姆逊发现电子后又被进一步归因于原子间的电子转移。例如钠原子失去一个电子变成正离子,氯离子得到一个电子变为负离子,正负离子结合形成氯化钠。但是对于如何解释同种原子之间、特别是有机分子中大量存在的碳原子之间的化学键,简单的电子转移理论遇到了极大的挑战。即使给这个理论打上各种补丁,其结果也不总是令人信服。
改变这一局面的是两位美国化学家——路易斯(G. N. Lewis)和朗缪尔(I. Langmuir)。他们两人早年都曾在德国物理化学大师能斯特(W. Nerst)指导下学习,回到美国后则走上了截然不同的职业道路。路易斯先后执教于哈佛大学、麻省理工学院和加州大学伯克利分校等多所高校,在化学热力学、分子结构和酸碱理论、以及同位素化学等方面颇有建树。朗缪尔的整个职业生涯都在通用电气公司度过,是少有的在工业界做出一流基础研究的化学家。凭借在表面化学领域的研究和发现,特别是对于气体吸附理论的贡献,朗缪尔被授予1932年诺贝尔化学奖。美国化学会在1985年创刊了一本名为Langmuir的期刊,专门发表表界面化学和胶体化学的研究论文。这是美国化学会出版的近百种学术期刊中唯一以人名命名的。

左:G. N. Lewis(1875~1946);右:I. Langmuir(1881~1957),1932年诺贝尔化学奖获得者

特。路易斯由此意识到原子中的电子并不等价,而很可能以某种形式“配对”存在。拆散配对的电子要比夺走“落单”的电子更加困难。另一方面,绝大多数稳定分子都拥有偶数个电子,含奇数个电子的分子(如自由基)一般较为活泼,并且能够相互结合使分子的电子数成为偶数。这让路易斯进一步将电子配对与化学键联系起来,认为两个原子可以共享一对电子,这对电子在空间上位于两个原子核之间,通过电子对与原子核的吸引在两个原子之间成键。电子对共享的程度则与原子束缚电子的能力有关。当两种原子束缚电子的能力差异极大时,电子对将严重偏向束缚能力强的原子,共享电子对就变回了电子转移。换句话说,路易斯提出的“共享电子对”是一种更加普适的化学键理论框架。
为什么两个电子可以克服同种电荷的斥力而配对呢?路易斯吸收了一名访问学生帕森(A. L. Parson)的见解——电子围绕原子核运动产生环电流,因而具备磁性,所以电子配对可能源于某种“磁作用”。今天我们知道自旋相反的电子配对是泡利不相容原理下的一种必然安排,和经典意义的磁作用并无关联。但是帕森–路易斯的假说绝非痴人呓语,反而极具前瞻性,可以视为对电子自旋现象和磁矩作用的粗浅描摹。毕竟泡利(W. Pauli)提出他著名的不相容原理,以及乌伦贝克(G. E. Uhlenbeck)和古德斯密特(S. A. Goudsmit)发现电子自旋都是十年之后(1925年)的事情了。
路易斯发明了有趣的“立方体原子”模型:把原子的价层电子置于立方体的顶点处,用两个立方体共用一条棱表示电子配对成键。而另一种更加简明直观的记法(路易斯结构式)是在元素符号旁用两个圆点表示一对电子,用一条线段表示原子通过共享电子对成键。虽然早在19世纪已有化学家用点和线辅助表示分子的组成,但是从路易斯开始,元素符号间的点和线才有了微观结构的内涵。路易斯的理论发表在1913和1916年的两篇长文中,而它的广泛传播则离不开朗缪尔的推动。朗缪尔创造了“共价键(covalent bond)”一词来概括共享电子对成键,并且通过深入的综述文章和富有感染力的演讲,发展和普及了共价键概念。后文中将要登场的化学键理论发展史上的关键人物鲍林(L. Pauling)和马利肯(R. S. Mulliken)都曾在回忆录中说,他们是通过阅读朗缪尔的文章才了解到路易斯的伟大贡献。
1920年代,路易斯–朗缪尔的学说流传到英伦三岛,激发了那里的一批有机化学家用电子理论检视有机分子的结构与反应机理,特别是如何理解单双键交替的共轭烃和芳香烃的反应性质。在激烈的思想交锋中,曼彻斯特大学/牛津大学的鲁宾逊(R. Robinson)首先意识到一些共享电子对并非限定在相邻原子之间,而是能够在分子内部“移动”。使用单一的路易斯式不能完整描述这些分子的结构和反应。他发明了用单钩或双钩箭头标注单个电子或电子对流向的方法,阐述分子在中性和极性结构之间的“互变”。利兹大学/伦敦大学学院的英戈尔德(C. K. Ingold)将这种互变命名为“中介效应”,并且通过测定分子的偶极矩和光谱实验证实电子对的移动是分子的固有性质,而不仅是其参与化学反应时的“应激现象”。在路易斯结构和电子理论的基础上,英戈尔德发展了一整套描述有机反应机理的范式和语言(包括亲电/亲核性、SN1/SN2取代等今天仍在使用的术语),建立了物理有机化学这门交叉学科。
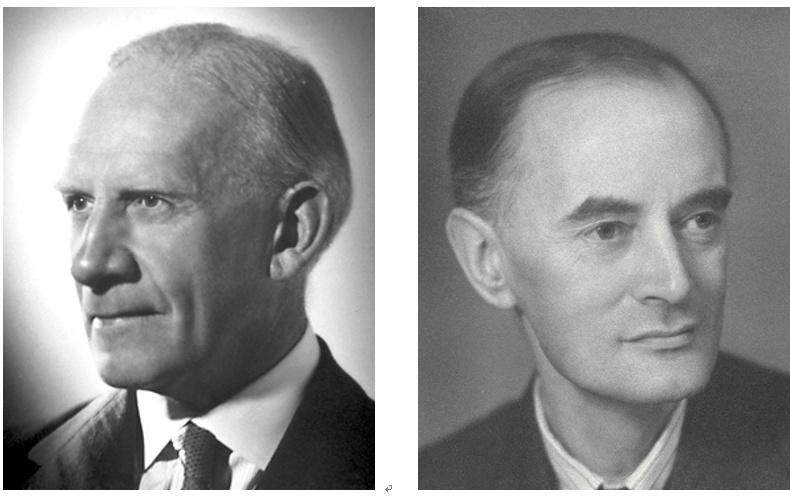
左:R. Robinson (1886~1975),1947年诺贝尔化学奖获得者;右:C. K. Ingold (1893~1970)
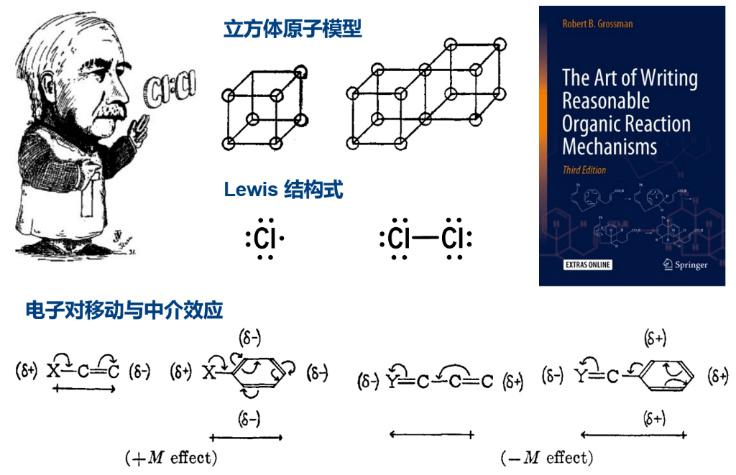
路易斯结构式与电子移动 | 部分图源:Chem. Rev. 1934, 34, 225. J. Compt. Chem. 2007, 28, 51.
在反应机理研究之外,鲁宾逊更是一位划时代的有机合成大师。1917年,他利用三步反应合成了天然产物托品酮,刷新了人们对于有机合成创造力的认知。由于在生物碱合成领域的贡献,鲁宾逊获得了1947年诺贝尔化学奖。但是在他晚年出版的自传中,鲁宾逊却说提出有机反应的电子理论才是他在科学上最重要的成就。遗憾的是,鲁宾逊与英戈尔德在该理论的优先权问题上积怨甚深,主要是鲁宾逊对英戈尔德在发表论文时总是没能恰当引用他的工作极为不满。根据一项最近发表的档案研究,从1940到1970年,英戈尔德曾被来自22个国家的77位提名者112次提名为诺贝尔化学奖候选人,但始终未能如愿。化学史研究者普遍相信,这是鲁宾逊利用他对诺贝尔奖评选委员会的影响力长期阻挠的结果。
从路易斯到英戈尔德的二十年间,由点、线和箭头组成的铁画银钩逐渐发展为有机化学的“世界通用语言”,为后来者思考有机分子的结构与成键提供了基本依据。毫不夸张地说,路易斯结构式变革了有机化学研究的面貌,为这门学科奠定了统一的形式逻辑和独特的精神气质。
花开两朵 | 共同的起点,迥异的道路
路易斯结构式作为旧量子论时代的产物,注定无法超越作为描述性概念的局限,不可能从定量的角度刻画有机分子结构与成键的复杂性和多样性:介于完全共价键和完全离子键之间丰富的中间状态是难以仅用点和线的图案来表示的。想要深入理解化学键的本质,阐明分子体系中电子的运动规律仍然必须从量子力学出发。但是困难之处在于对任何超过一个电子的化学体系,薛定谔方程不仅无法求得解析解,而且在计算机诞生之前就连数值计算也显得不切实际。为了处理化学键问题,必须发展新的融合理论计算与简明化学图像的近似工具。幸运的是,上世纪20~30年代一批最有才华的年轻人为我们发展了两套这样的工具:价键理论(valence bond theory,VB)和分子轨道理论(molecular orbital theory,MO)。它们从求解氢气分子这个共同的起点出发,沿着迥异的道路演进,最终殊途同归,从不同侧面描绘了分子世界的奇妙情景。
花开两朵,各表一枝,让我们先从价键理论开始。这条道路上里程碑式的人物无疑是鲍林,这个从美国波特兰一个贫困药剂师家庭走出的科学巨人。鲍林很早就展现出化学方面的才能。就读于俄勒冈农学院的第二年,他就受聘给同校学生讲授定量化学的课程,被戏称为“教授男孩”。大学毕业后,鲍林来到德国慕尼黑,跟随索末菲(A. Sommerfeld)学习物理,并在欧洲结识了海森堡(W. Heisenberg),泡利,薛定谔(E. Schrödinger),狄拉克( P. A. M. Dirac)等量子力学黄金年代几乎所有的重要人物。过人的天赋和独特的经历让鲍林有能力连接量子力学和化学这两个原本彼此隔绝的科学领域。他掌握了那个年代绝大多数化学家不曾了解的数学与物理知识,又远比一般的物理学家更加熟悉化学中亟需解决的难题。

L. Pauling(1901~1994),1954年诺贝尔化学奖获得者,1962年诺贝尔和平奖获得者
1927年,薛定谔指导的两位博士后海特勒(W. Heitler)和伦敦(F. London)首次将量子力学应用于氢气分子并取得成功。他们的计算表明两个独立的氢原子在彼此靠近的过程中能够通过“交换电子”降低体系的能量,同时提升两个氢原子核之间的电子密度,最终形成氢–氢化学键。鲍林曾在瑞士苏黎世当面与海特勒和伦敦交流。他敏锐地意识到了他们的计算与路易斯–朗缪尔的共价键概念之间的关联,并且坚信这是将量子力学引入化学键问题的绝佳途径。
回到美国后鲍林在加州理工学院工作。1931~1933年间他连续发表七篇论文,系统阐述了价键理论,其核心思想包括:两个原子的价层原子轨道重叠形成共价键;参与成键的原子轨道的对称性必须匹配;共价键的方向由原子轨道的最大重叠方向决定。鲍林进一步指出为了适应成键的需要,能量相近的价层原子轨道可以通过线性组合形成杂化轨道。他用

的复杂有机分子(如芳香烃),鲍林提出了“共振论”的观点:认为分子的真实结构是那些可以由路易斯式表示的正则结构的共振。共振造成体系能量的降低,分子的真实能量比所有正则结构都来得低。某种正则结构的能量越低,那么它对体系真实结构的贡献比例就越大。鲍林以双原子分子生成焓的实验数值为基础建立了元素的电负性标度,不仅量化了不同元素原子束缚电子的能力,而且原则上可以定量分析任意化学键的共价或离子程度。
在鲍林看来,价键理论(特别是共振论)已经完美刻画了从离子晶体到有机分子、甚至金属中所有类型的化学键。即使数学上不绝对严格,也足以揭示化学键的本质。1938年,鲍林出版了他的名著《化学键的本质》,并于1940和1960年两度再版(该书第三版有国内卢嘉锡先生、黄耀曾先生等人的中译本)。关于化学键本质的研究为鲍林赢得了无数的荣誉,包括1954年诺贝尔化学奖。随着时间的推移,鲍林的兴趣逐渐转向生物大分子,他是使用X-射线晶体衍射实验测定生物大分子结构的先驱。基于对血红蛋白的研究,鲍林提出了α螺旋和β折叠作为蛋白质二级结构的理论。二战后,鲍林已然是美国科学界举足轻重的人物,战争的后果促使他成为积极的和平主义者。他参与了爱因斯坦(A. Einstein)和西拉德(L. Szilárd)发起的原子能科学家紧急委员会,呼吁人民警惕核武器的危险。由于反对美苏核军备竞赛的努力,鲍林被授予1962年诺贝尔和平奖。他是迄今为止唯一两次单独获得诺贝尔奖的人。

各种版本的《化学键的本质》 | 图源:维基百科
在鲍林大力推动价键理论发展的同时,另一条道路上的探索也在悄然进行。不过从某种程度上说,分子轨道理论的最初建立并不是源于解决化学问题的需要,而是物理学家对原子光谱长期研究的自然延续。气态原子受激发后会产生线状光谱,这是19世纪中叶以来物理学家就已经十分熟悉的现象。原子谱线的波长与其电子能级密切相关,研究原子光谱是了解原子结构、进而催生量子理论的重要动力。上世纪20年代,随着原子光谱的实验和理论日趋完善,人们的目光开始转向更加复杂的分子光谱。马利肯和洪特(F. Hund)这两位光谱学领域已经崭露头角的年轻人在探索分子光谱规律的过程中,从与化学家完全不同的视角开辟了处理化学键问题的全新思路。

R. S. Mulliken (左) (1896~1986),1966年诺贝尔化学奖获得者与F. Hund (右)(1896~1997)
1925年,马利肯作为哈佛大学的博士后在美国国家科学研究委员会的资助下到欧洲访学。他在德国哥廷根第一次见到洪特,哥廷根大学理论物理研究所的话事人玻恩(M. Born)的助手。也是在这段时间,洪特发表了他最为人熟知的成果:洪特规则——电子在简并轨道排布时,具有最高自旋多重度的状态能量最低。共同的研究兴趣让马利肯和洪特都将对方视为学术上的知己,并从此建立了持续半个多世纪的友谊。
1925~1928年间,马利肯和洪特提出了一种“联合原子”策略处理双原子分子问题。与价键理论考虑两个独立氢原子逐渐靠近、通过交换电子将彼此连接形成氢气分子不同,联合原子策略假想氢气分子是由含两个电子的氦原子“分裂”而来。这种分裂使得氦原子的1s原

1929年,英国布里斯托大学的伦纳德-琼斯(J. E. Lennard-Jones)提出用原子轨道线性组合(LCAO)的方式构造分子轨道。1930~1931年,德国斯图加特大学的休克尔(E. Hückel)把分子轨道理论应用于有机共轭分子(特别是交替烃和芳香烃)。他通过分离σ和π电子、以及忽略非相邻π电子的交换积分和重叠积分等近似方式,能够方便地计算共轭体系的分子轨道系数和能级。在此基础上,休克尔指出π电子数为4n + 2的平面环状共轭分子具有“芳香性”(休克尔规则),为长期困扰有机化学家的芳香性问题提供了明确的判据。

Mulliken签名的邮票首日封 | 图源:amazon.com
价键理论和分子轨道理论的重要分野是如何看待分子体系中电子的“离域性”。从价键理论的视角来看,共享电子对首先被完全定域在相邻原子之间,然后通过多个正则结构的共振体现电子的离域特征。这承袭了有机化学家对分子结构的一般认识。而分子轨道理论完全抛弃了电子定域的假设,让所有电子都在分子轨道中充分离域。利用一系列分子轨道为分子整体建立能级,可以很好地对应分子在光谱实验中的行为。虽然在基本原理和数学处理方式上价键理论和分子轨道理论有很大差异,但是早在1932年,麻省理工学院的斯莱特(J. C. Slater)——他与鲍林同时独立提出了杂化轨道方法——就已证明了二者的等价性:考虑全部正则结构的价键理论和考虑全部电子组态的分子轨道理论将给出一致的结论。事实上,通过代数上的酉变换将离域的分子轨道定域化,就能得到与价键理论相近的化学图像。尽管如此,分子轨道理论被提出后的头二十年还是受到了化学家的冷遇,直到1950年代它在化学上的重要性才得到普遍认可。在美国芝加哥大学任教的马利肯作为分子轨道理论的主要创立者,被授予1966年诺贝尔化学奖。获奖后他收到了学界同行的广泛祝贺,其中有一份特别的祝贺来自洪特。马利肯在许多场合高度评价洪特为创立分子轨道理论所做的重要贡献,他说自己原本非常希望能与这位好朋友分享诺贝尔奖的殊荣。
本文受科普中国·星空计划项目扶持
出品:中国科协科普部
监制:中国科学技术出版社有限公司、北京中科星河文化传媒有限公司

特 别 提 示
1. 进入『返朴』微信公众号底部菜单“精品专栏“,可查阅不同主题系列科普文章。
2. 『返朴』提供按月检索文章功能。关注公众号,回复四位数组成的年份+月份,如“1903”,可获取2019年3月的文章索引,以此类推。
版权说明:欢迎个人转发,任何形式的媒体或机构未经授权,不得转载和摘编。转载授权请在「返朴」微信公众号内联系后台。





 2024-01-27
2024-01-27


 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国