研究历程
疟疾是人类最古老的疾病之一,至今依然还是一个全球广泛关注且亟待解决的重要公共卫生问题。
早在 1631 年,意大利传教士萨鲁布里诺(Agostino Salumbrino)从南美洲秘鲁人那里获得了一种有效治疗热病的药物——金鸡纳树皮(cinchona bark)并将之带回欧洲用于热病治疗,不久人们发现该药对间歇热具有明显的缓解作用。1820 年法国化学家佩尔蒂埃(Pierre Joseph)和药学家卡文托(Joseph Bienaimé Caventou)从金鸡纳树皮分离治疗疟疾的有效成分并将之命名为奎宁(quinine)。
1944 年美国有机化学家伍德沃德(Robert Woodward)与德林(William Doering)第一次成功地人工合成奎宁。此后,科学家们对抗疟药不断改进,形成了以奎宁等为代表的芳、杂环甲醇类,以氯喹等为代表的 4 -氨基喹啉类,以及以阿莫地喹等为代表的杂环氨酚类抗疟药。这些抗疟药在人类防治疟疾方面起到了重要作用。

20世纪60年代初,恶性疟原虫在一些区域已经出现对氯喹的抗药性,尤以东南亚最为严重。当时,随着越南战争的逐步升级,抗氯喹恶性疟的侵袭困扰交战双方,导致作战部队大量减员。为此,美国投入大量的人力、物力来研究疟疾,主要目标是寻找新型的抗疟药物。其中,美国华尔特·里德陆军研究所(Walter Reed Army Institute of Research)从20世纪60年代末开始筛选了20多万种化合物。越南方面受条件所限,无力研制开发新药,于是请求中国帮助解决疟疾防治问题。9
1967年5月23日,国家科委、中国人民解放军总后勤部在北京联合召开会议。会议决定,争取在较短时间内重点解决抗药性疟疾的防治药物、抗药性疟疾的长效预防药和驱避剂三个方面的问题。设立代号为523项目的抗疟药物研究工作。在接下来14年中,来自60所军民机构的500位科学家参与了此项目。9

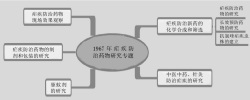
前期探索——从传统药物中筛选目标产物
“523任务”制定的《中医中药、针灸防治疟疾研究规划方案》第二项为“民间防治疟疾有效药物和疗法的重点调查研究”。该方案的备注中列出了根据文献调查提出的作为重点研究的药物,其中列有青蒿(排在第5位)。但是,在之后的记录中没有发现有关青蒿筛选的相关记载。9
1969年1月21日,中医研究院(现中国中医科学院)中药研究所加入“523任务”的“中医中药专业组”,屠呦呦被任命为中医研究院项目小组组长,组员是余亚纲和郎林福。
1970年,“全国523办公室”安排军事医学科学院的顾国明到北京中药所协助他们从传统中药中寻找抗疟药物。余亚纲查阅中医药文献,并且以1965年上海市中医文献馆出版的《疟疾专辑》为蓝本,进行整理分析后列出重点筛选的药物为:乌头、乌梅、鳖甲、青蒿等。他们共用水煎或乙醇提取,筛选了近百个药方,北京中药所档案显示,从1970年2月开始,屠呦呦小组一共送了10批166种样品到军事医学科学院进行检测,其中第8批中最后一个药物为雄黄,抑制率为100%;第9批中也出现了几次雄黄,抑制率均在90%以上;青蒿出现第10批样品中,抑制率显示为68%,其提取溶剂为乙醇。
1971年下半年,屠呦呦领导的科研小组(包括钟裕蓉、郎林福等)从东晋葛洪《肘后备急方之治寒热诸疟方》中“青蒿一握,以水二升渍,绞取汁,尽服之”的记载中受到了启发,认为温度高有可能对青蒿有效成分造成破坏而影响疗效,便由用乙醇提取改为用沸点比乙醇低的乙醚提取。9
青蒿素的发现
1971年5月21日~6月1日全国疟疾防治研究工作座谈会在广州召开,会后,北京中药所重新组织了研究小组,屠呦呦仍任组长,与组员钟裕蓉继续提取中药,郎林福和刘菊福做动物试验。根据北京中药所的药物筛选记录,1971年7月26日筛选(序号16)青蒿抑制率12%,9月1日(序号114)青蒿醇抑制率40%,10月4日(序号191)青蒿乙醚抑制率达100%。1971年1月起,屠呦呦小组开始大量提取青蒿乙醚提取物,并于当年6月底完成了狗的毒性试验。为了能尽快开展临床试验,在当年对青蒿乙醚提取物对狗的毒性试验结果尚存在一定争议的同时,6~8月期间,屠呦呦、郎林福、岳凤仙与章国镇、严述常、潘恒杰、赵爱华、方文贤先后以不同剂量分作两批进行了青蒿乙醚中性提取部分的自体试服,均未出现明显的毒副作用。
1972年3月8日,屠呦呦作为北京中药所的代表,在“全国523办公室”主持的南京“中医中药专业组”会议上作题为《用毛泽东思想指导发掘抗疟中草药工作》的报告,报告了青蒿乙醚中性粗提物的鼠疟、猴疟抑制率达100%的结果,引起全体与会者的关注。资料显示,复筛时屠呦呦从本草和民间的“绞汁”服用的说法中得到启发,考虑到有效成分可能在亲脂部分,于是改用乙醚提取,这样动物效价才有了显著提高,使青蒿的动物效价由30%~40%提高到95%以上。
1972年8月,屠呦呦带队在海南岛开展青蒿乙醚中性提取物的临床疗效试验。期间,倪慕云设计了色谱柱分离的前处理,使青蒿乙醚提取物中性部分的抗疟作用再次得到提高。钟裕蓉从文献获知硅胶柱分离中性化合物更有效,于是便与助手崔淑莲在倪慕云柱前处理的基础上,按文献提供的方法用硅胶柱层析,石油醚-乙醚(后改为石油醚-乙酸乙酯)梯度洗脱,分离乙醚中性提取物。
1972年11月8日,改用上海试剂厂生产的硅胶柱分离,然后用石油醚和乙酸乙酯-石油醚(不同比例)多次洗脱。最先获得少量的针状结晶,编号为“针晶Ⅰ”(No.1或针1);随后洗脱出来的针状结晶编号为“针晶Ⅱ”(No.2或针2);再后来得到的另一种方形结晶,编号为“结晶Ⅲ”(No.3或方晶)。同年12月初,经鼠疟试验证明,“针晶Ⅱ”是唯一具备抗疟作用的有效单体。此后,北京中药所向“全国523办公室”汇报时,将抗疟有效成分“针晶Ⅱ”改称为“青蒿素Ⅱ”,有时也称青蒿素。再后,北京中药所均称“青蒿素Ⅱ”为青蒿素。9
1975年6月,北京中药所重新开展青蒿素的临床研究,与湖北健民制药厂合作,用四川酉阳黄花蒿、云南溶剂汽油法提取青蒿素(黄花蒿素),分别在海南或与湖北医科院、武钢和河南等单位合作进行的。
1977年《科学通报》第22卷第3期,首次发表了青蒿素化学结构及相对构型的论文,题目是《一种新型的倍半萜内酯——青蒿素》。13青蒿素的结构完全公诸于世。
其他抗疟药物的发现
1972年10月21日,山东省寄生虫病研究所研究人员在用乙醚及酒精对山东产的黄蒿进行提取,经动物试验,获得较好的效果后,向“全国523办公室”作了书面报告并指出:黄花蒿的提取物抗鼠疟的结果,与北京中药所青蒿提取物的实验报告一致。当年11月,山东省中医药研究所从山东省泰安地区采来的黄花蒿(ArtemisiaannuaL.)中分离提取出7种结晶,其中第5号结晶命名为“黄花蒿素”,具有抗疟作用。1972年底,云南“523办公室”副主任傅良书得知了北京中药所青蒿研究的情况后,提出利用当地植物资源丰富的有利条件,对菊科蒿属植物进行普筛。
1973年,罗泽渊在云南大学校园内发现了一种一尺多高、气味很浓的艾属植物——“苦蒿”,结果发现“苦蒿”的乙醚提取物有抗疟效果,复筛后结果一样后改称为“黄蒿素”。9
1978年,蒿甲醚与青蒿琥酯分别研制成功。
1989年12月,“抗疟新药——青蒿琥酯”获得国家发明三等奖。
1996年12月,中国科学院上海药物研究所的“抗疟新药——蒿甲醚”发明获得国家发明三等奖。
结构测定
1973年初,北京中药所开始着手对青蒿素Ⅱ进行结构测定,但由于化学研究力量和仪器设备薄弱,结果不理想。
自1974年2月到1976年间,北京中药所先后派出倪慕云、钟裕蓉、樊菊芬和刘静明到中国科学院上海有机化学研究所(简称“有机所”)参与结构测定工作。
1975年,屠呦呦与中国科学院生物物理研究所(简称“生物物理所”)取得联系并开展协作,用当时国内先进的X衍射方法测定青蒿素的化学结构。在1975年底至1976年初得到了青蒿素的晶体结构。后经梁丽等在精细地测定反射强度数据的基础上,确立了青蒿素的绝对构型。9
临床验证
1973年9月,北京中药所研究人员带上所里分离获得的青蒿素Ⅱ100多克赴海南开展临床验证,一共做了8例临床,其中恶性疟5例、间日疟3例。结果显示,青蒿素对间日疟有效,但是未能证明对恶性疟的效果。
1974年5月中上旬,山东省黄花蒿协作组在山东巨野县城关东公社朱庄大队用黄花蒿素对10例间日疟患者进行临床观察,效果很好。9月8日,云南临床协作组的陆伟东、王学忠带着黄蒿素到云县、茶坊一带进行临床效果观察。并且提供药给广东中医学院的李国桥率医疗队开展的脑型疟的救治以及“7351”的临床验证等工作。到当年年底,广东医疗队共验证了18例,其中恶性疟14例(包括孕妇脑型疟1例、黄疸型疟疾2例)、间日疟4例。汇集之前云南协作组验证的3例患者,云南提取的黄蒿素首次共验证了21例病人,其中间日疟6例、恶性疟15例,全部有效。此次试验明确了黄蒿素对恶性疟疾的效果。
1975年4月,在成都召开了“523任务”中医中药专业座谈会。由于李国桥等用黄蒿素治疗恶性疟取得了良好效果,制定了当年的研究计划,开始进行全国范围内的临床验证。9
截至1978年11月青蒿素(包括黄花蒿素、黄蒿素)治疗疟疾科研成果鉴定会时,参与青蒿及青蒿素研究和协作的单位有45家之多。这些单位用青蒿粗制剂、青蒿素共进行了6555例的临床验证,用青蒿素制剂治疗的有2099例,其中恶性疟588例(含脑型疟141例)、间日疟1511例。
青蒿素改进
青蒿素对疟疾具有速效、低毒的特点,但是用后其“复燃率”很高,而且只能口服,生物利用度低,且因溶解度小而难以制成注射剂液用于抢救严重病人。
1976年2月,“全国523办公室”将青蒿素结构改造的任务下达给中国科学院上海药物研究所(简称“上海药物所”)。上海药物所发现双氢青蒿素的效价比青蒿素高1倍。由于双氢青蒿素的分子中存在半缩醛的结构,性质不够稳定,而且溶解度也未见改善。李英等又从双氢青蒿素出发合成了它的醚类、羧酸酯类和碳酸酯类衍生物。顾浩明等通过动物试验,发现几十个衍生物的抗疟活性几乎都高于青蒿素。其中,SM224(后命名为“蒿甲醚”)的油溶性大、性质稳定,抗疟活性是青蒿素的6倍9。
1977年8月,桂林制药厂刘旭等设计合成了10多个青蒿素衍生物;其中双氢青蒿素的琥珀酸半酯在鼠疟筛选中抗疟效价比青蒿素高3~7倍,可生成溶于水的钠盐,用于制备水溶性静脉注射剂,是救治重症疟疾的速效、方便使用的剂型。
1978年7~9月,在完成药学、药理、药代、药效、毒理、制剂等实验研究后,领导小组批准蒿甲醚在海南岛进行首次临床试验,临床试验证明疗效很好。
1990年,北京中药所邀请中国医学科学院药物研究所、军事医学科学院微生物流行病研究所等单位讨论,认为双氢青蒿素是蒿甲醚和青蒿琥酯的体内活性代谢产物,而且生产成本较低,可以作为开发对象。于是启动了对双氢青蒿素的抗疟药理、毒理和安全性的评价,后由广州中医学院进行临床试验,先后在海南岛收治恶性疟患者349例。其中,7天疗程总剂量480毫克治疗了239例,观察28天后,发现治愈率达97.5%,结果表明双氢青蒿素具有良好的抗疟效果。9
青蒿素组方
1982年下半年,军事医学科学院周义清和滕翕和向中国青蒿素及其衍生物研究指导委员会提出“合并用药延缓青蒿素抗性产生的探索研究”立题申请,得到批准,并提供启动经费。邓蓉仙、滕翕和组织自主研发的本芴醇(也是“523任务”期间的成果之一)与青蒿素组方既显示出速效的特点,又有治愈率高的优点。最后经过鼠疟、猴疟的各种实验之后发现蒿甲醚和本芴醇1:6配比适宜,并于1992年完成了全部研究工作。为了进一步提高疗效,缩短疗程,延缓抗药性的产生,中国科学家用青蒿素及其衍生物与“523任务”期间或之后化学组研究人员研发的新化学抗疟药配伍,不仅发明了蒿甲醚本芴醇复方(coartem),还有双氢青蒿素磷酸哌喹复方(artekin)、青蒿素磷酸萘酚喹复方(arco)、复方哌喹片(CV8)、青蒿素-哌喹片(artequick)等。青蒿素类抗疟药组成复方或联合用药(ACTs),已被世界卫生组织(WHO)确定为全球治疗疟疾必须使用的唯一用药方法。利用青蒿素类药复方加服小剂量的伯喹治疗现症病人以阻止疟疾传播的技术,也被WHO确认和推荐。9
2016年,科学杂志《eLife》刊登,德国马克斯普朗克分子植物生理学研究所专家发明了利用COSTREL方法从烟草中大量提取青蒿素的方法。2019年6月17日,新华社电,经过三年多科研攻坚,屠呦呦团队在“抗疟机理研究”“抗药性成因”“调整治疗手段”等方面终获新突破,提出新的治疗应对方案:一是适当延长用药时间,由三天疗法增至五天或七天疗法;二是更换青蒿素联合疗法中已产生抗药性的辅助药物。国际顶级医学期刊《新英格兰医学杂志(NEJM)》刊载了屠呦呦团队该项重大研究成果和“青蒿素抗药性”治疗应对方案。
物理性质
青蒿素的分子式为C15H22O5,分子量282.34。它是一种新型倍半萜内酯,具有过氧键和δ-内酯环,有一个包括过氧化物在内的1,2,4-三噁烷结构单元,这在自然界中是十分罕见的,它的分子中包括有7个手性中心。它的生源关系属于青蒿素类型,其特征是A、B环顺联,异丙基与桥头氢呈反式关系,青蒿素中A环碳架被一个氧原子打断。1
青蒿素为无色针状结晶,熔点为156~157℃,[α]17D=+66.3°(c=1.64氯仿)。易溶于氯仿、丙酮、乙酸乙酯和苯,可溶于乙醇、乙醚,微溶于冷石油醚,几乎不溶于水。因其具有特殊的过氧基团,它对热不稳定,易受湿、热和还原性物质的影响而分解。IR谱(KBr)具有一个六元环内酯(1745 cm)和过氧基团(831,881,1115 cm-1)。不含双键,无紫外吸收。高分辨质谱(m/e282.1472M+)及元素分析(C63.72%,7.86%)。结晶学参数:空间群,晶胞参数a=24.098 Å,b=9.468 Å,c=6.399 Å。密度:实验d0=1.30 g/cm3,计算d0=1.294 g/cm3,单胞中分子数Z=4。1
化学性质
青蒿素是一种内酯,因而可以与盐酸羟胺发生反应,产物遇铁离子显色。虽然青蒿素含有过氧键,但相较于其他的过氧化物,青蒿素化学性质较为稳定,加热到熔点仍不分解。青蒿素可被三苯膦或碘离子定量地还原,这一反应可用于定量分析。在常压和钯-碳酸钙催化下,青蒿素的过氧键可被氢气还原,生成氢化青蒿素(C15H22O4)。以硼氢化钠处理青蒿素,则内酯的羰基被还原,生成半缩醛还原青蒿素(C15H24O5)。131617
室温下以碳酸钾甲醇溶液处理青蒿素一小时,酸化后可以得到一种含有环氧基团的五元环内酯(C15H20O4);以硫酸-乙酸处理青蒿素可以得到另一种五元环内酯(C14H20O3)。16
过氧基团反应
青蒿素与三苯基磷反应可以证明青蒿素含有一个当量的过氧基,其做法是青蒿素在三苯基磷和二甲苯溶液中通氮气回流,再加甲醛及水搅拌,水洗有机层,合并水层及酸性溶液,加碱后,用无过氧化物乙醚提取,无水硫酸钠干燥,除去乙醚,测得三苯基磷重量,结果证明消耗三苯基磷克分子数与青蒿素相近。1
显色反应
显色反应是用以鉴定青蒿素简单可行的方法,报道较多,主要有以下几种:
(1)对二甲氨基苯甲醛缩合反应:取实验产品青蒿素约10 mg,加乙醇2 mL溶解,加对二甲氨基苯甲醛试剂1 mL置水浴上加热,溶液呈蓝紫色反应。
(2)异羟肟酸铁反应:取样同(1),溶于1 mL甲醇中,加入φ=7%盐酸羟胺甲醇溶液4~5滴,在水浴上加热至沸,冷却后加稀盐酸调至酸性,再加入φ=1%FeCl3,乙醇溶液1~2滴,溶液呈紫红色反应。
(3)2,4-二硝基苯肼反应:取样同(1),溶于1 mL氯仿后,滴于滤纸片上,以2,4-二硝基肼试液喷洒,在80 ℃烘箱中烘10 min,产生黄色斑点。
(4)碱性间二硝基苯反应:取样同(1),溶于2 mL乙醇中,加入φ=2%间二硝基苯的乙醇液和饱和的KOH乙醇液各数滴,水浴微热,溶液呈红色反应。1
氢解反应
青蒿素在含有钯-碳酸钙的甲醇溶液中,在常温、常压下催化氢化,过氧化物被还原成化合物Ⅲ(图5中的Ⅲ)。在此反应过程中,反应最初所得为油状物,若将其溶于有少量丙酮的正己烷中,需放置4~5 d,变为化合物Ⅲ的晶体,而在重氮甲烷中则甲酯化得到甲酯化合物Ⅳ(图5中的Ⅳ)。1
还原反应
青蒿素溶于甲醇,在冰浴中(0~5 ℃)搅拌分次慢慢加入固体硼氢化钠,加完后继续搅拌半小时。反应液用冰醋酸中和,减压除去溶媒,即得到化合物Ⅴ(图5中的Ⅴ)的粗结晶产物,它是用硼氢化钠还原青蒿素而得到的半缩醛化合物。如用钯-碳酸钙在常温常压下进行催化氢化,则会失去氧而得到环氧化合物。1
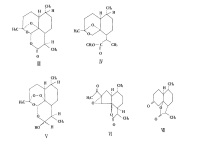
与碱反应
青蒿素加甲醇溶解,另取碳酸钾溶于水,将此碳酸钾溶液在搅拌下缓缓加入青蒿素甲醇溶液,使成均匀混和成澄清液,在20~22 ℃恒温1 h,加入水,用乙醚提取两次,醚层用少量水洗2次,水层用φ=10%盐酸酸化至pH=2,再用乙醚提取3次。乙醚层用水洗至中性,经无水硫酸钠干燥2~3 h,乙醚层减压抽干,所得残余物放冰箱过液,有半固体析出,加少许甲醇,冷却,析出针状结晶,即为化合物Ⅵ(图5中的Ⅵ),过滤再结晶一次,则得到更精制的结晶。1
与酸反应
青蒿素加入到冰醋酸-浓H2SO4混合液中摇匀,使溶解,25℃放置16~17 h,溶液呈浅棕黄色微带荧光,将反应液倒入等体积冰水中,搅匀,用氯仿提取3次,氯仿层用水冲洗至中性,无水硫酸钠干燥,减压除去有机溶剂,得粗结晶,重结晶2次,即得化合物Ⅶ(图5中的Ⅶ)的片状结晶,熔点144~146 ℃,[α]10D=-16.2°(c=2.1氯仿)。1
制备方法
化学合成
1983年,罗氏公司的研究员G.Schmid和W.Hofheinz以薄荷醇为原料首次完成了青蒿素全合成。随后,上海有机所的周维善等人以香草醛为原料完成了这一全合成。至2003年已有十余种青蒿素全合成路线。这些路线的起始物包括薄荷酮、3-蒈烯和环己烯酮18192021
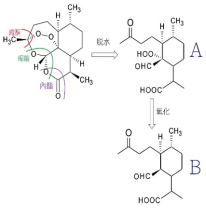
青蒿素全合成的逆合成分析
从逆合成分析的角度看,青蒿素的一个特点是它的结构中含有一个1,2,4-三?唑环。该环实际上是一个缩酮-缩醛-内酯体系的一部分,可以由上图中α-过氧羟基醛(A)经缩合反应构建。过氧羟基醛(A)又可以由醛(B)的烯醇醚或类似化合物经过氧化反应获得。过氧化是青蒿素合成中的关键步骤,尽管不同的路线采用不同的方法引入过氧基团,这步反应产率总是比较低。202122
Schmid等人、Ravindranathan等人、Lansbury等人、周维善等人利用烯醇醚在低温、光照和光敏剂存在下与单线态的氧分子发生的[2+2]环加成反应产生四员环中间体,然后开环形成过氧化物;Avery等人则利用烯基硅烷的反常臭氧化反应引入过氧基团。用酸处理过氧化产物就可以得到青蒿素。2023
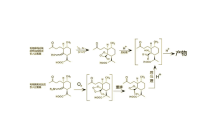
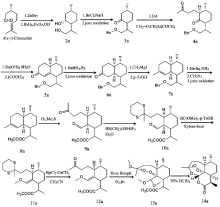
1989年,Nancy Acton等人发现,在低温和光照下,二氢青蒿酸可以被两当量的氧气直接氧化成青蒿素,产率17%-32%。后续研究表明在反应中,二氢青蒿酸先与一分子单线态氧发生烯反应,生成过氧化物。再与另一分子三线态氧反应,开环生成α-过氧羟基醛(A),最后脱水产生青蒿素。不久这一反应就被用于改进青蒿素的全合成路线。2425但化学合成青蒿素工艺繁杂,步骤多,成本高,易污染,尤其引入过氧基团的光氧化或化学氧化的产率不理想,导致化学全合成工艺一直无法用于青蒿素的商业化生产。
生物合成
青蒿素存在于中草药青蒿的花叶中,茎中不含有,是一种含量非常低的萜类化合物,生物合成途径非常复杂。
现已知可通过三种方式进行青蒿素的生物合成,一是通过对控制青蒿素合成的关键酶进行调控,添加生物合成的前体来增加青蒿素的含量;二是激活关键酶控制的基因,大幅度增加青蒿素的含量;三是利用基因工程手段改变关键基因,以增强它们所控制酶的作用效率。
生物合成过程中,青蒿素的含量受光照、外源激素、芽分化等生理生态因子的影响很大,温度对于生物合成也有极大影响,通过试验研究发现,青蒿幼苗在40℃条件下,处理36h后,青蒿素的质量分数提高到最大为68%。
除青蒿之外,其它植物也可以合成青蒿素,2011年研究人员从烟草中合成青蒿素。此方法与传统化学方法相比,所用的化学试剂大大减少,有利于环境的保护,且该生物合成方法的受体为烟草,在中国较为广泛,因此原料来源较为丰富,但不足的是用烟草合成青蒿素过程中的某些反应基质并不清楚,还有待开发,但该合成方法仍有较好的工业应用前景。25
美国科学家Keasling将一个青蒿基因植入大肠杆菌,改造后的大肠杆菌制造出一种中间化合物,这种化合物经过数步处理就能成为青蒿素的原料——青蒿酸。把一种特殊的酶植入酵母后,酵母把前面提到的中间化合物改造成了青蒿酸。通过微生物工业生产青蒿素的技术链条已经基本成形。如果这一想法得到实现,意味着青蒿素的价格将下降90%。26
2013年4月25日出版的Nature杂志发表了美国Keasling小组和加拿大Covello小组的两国科学家撰写的研究通信《强效抗疟剂青蒿素的高水平半合成生产》一文,报道了将酵母工程菌中青蒿素前体青蒿酸的发酵产量从1.6克/升提高到25克/升,并利用单线态氧成功地将青蒿酸转化成青蒿素。
提取纯化
分离纯化工艺主要有溶剂外加能量协助提取法、提取重结晶法、超临界CO2萃取法和溶剂提取层析法。
溶剂提取重结晶法一般采用的溶剂汽油法,乙醇法和碱水提取酸沉淀法进行生产,此类方法明显增加了青蒿素植物的有效利用率。
**碱水提取酸沉淀法:**取一定量的青蒿枝叶干粉加入乙醇搅拌浸提,得到乙醇提取液,减压干燥,将其溶于乙醚-水两相溶液中,分别得到青蒿素和青蒿酸。此种方法的青蒿酸收率达到90%,青蒿素的提取率为57%。25
**乙醇法:**取一定量的青蒿枝叶干粉,用稀乙醇浸泡24 h,得到乙醇提取液,将其注入连续萃取装置,再用含苯和乙酸乙酯的溶剂汽油萃取,得到醇相和萃取相,醇相可循环使用,萃取相用活性炭脱色,过滤,回收溶剂,然后得到浓溶液,再冷却结晶得到青蒿素粗晶物,再用乙醇重结晶得到青蒿素成品。此方法有收率较高,成本较低,步骤较少,操作简单,安全等优点。25
**溶剂汽油法:**取一定量的青蒿枝叶干粉,用8~10倍120号溶剂汽油浸泡3次,得到溶剂汽油提取液,再减压浓缩并放置结晶,得青蒿素粗品,用少量120号溶剂汽油多次洗涤,50%乙醇醇结晶2~3次,最终得到青蒿素白色针晶。此种方法工艺步骤简便,容易大批量生产使用。25
溶剂提取层析法有三种提取方法,分别是丙酮-硅胶柱层析法、低沸汽油-超短粗型球状扩孔硅胶层析法、乙烷提取-乙烷/乙腈-硅胶柱层析法。25
应用领域
提到青蒿素,人们首先会想到它的抗疟疾功用,WHO认为,青蒿素是治疗疟疾耐药性效果最好的药物,以青蒿素类药物为主的联合疗法,也是当下治疗疟疾的最有效最重要手段。但是近年来随着研究的深入,青蒿素其它作用也越来越多被发现和应用研究,如抗肿瘤、治疗肺动脉高压、抗糖尿病、胚胎毒性、抗真菌、免疫调节等。25
抗疟疾
疟疾(俗称:打摆子寒热病)属于虫媒传染病,是受疟原虫感染的按虫叮咬人体后而引起的一种传染病,长时间多次发作后出现可肝脾肿大,且伴随贫血等症状。疟疾能够得到一定程度的治疗,青蒿素功不可没。青蒿素结构中过氧键具有氧化性,是抗疟的必需基团。作用机理是青蒿素在体内产生的自由基团与疟原蛋白结合,改变疟原虫的细胞膜结构。自由基团与疟原蛋白结合之后会使线粒体的双层膜胀裂,最终脱落,导致疟原虫的细胞结构和功能受到破坏,同时细胞核内的染色质也会受到一定的影响。另一方面,氨基酸是构成蛋白质的基本物质,青蒿素作用后。疟原虫对异亮氨酸的吸收减少,导致虫体蛋白的合成受阻。黄花蒿不仅可以杀灭病原虫,还具有抗血吸虫作用、治疗弓形虫感染作用、抗卡氏肺孢子虫作用、抗球虫作用等。经临床试验证明,青蒿素及其衍生物在治疗疟疾的过程中,并未发现特别明显的副作用。25
抗肿瘤
恶性肿瘤是危害人类健康的第一大杀手,若不及时医治则会危害生命安全。体外实验表明,一定剂量的青蒿素可以使肝癌细胞、乳腺癌细胞、宫颈癌细胞等多种癌细胞的凋亡,明显抑制癌细胞的生长。研究发现,青蒿素可以调控肿瘤细胞的周期蛋白表达,增强CKIs作用,导致肿瘤细胞周期阻滞;或者导致细胞凋亡,抑制肿瘤血管生成等来抵抗肿瘤的发生和发展。青蒿素对白血病的治疗,是通过作用在白血病细胞的细胞膜,增加膜的通透性,改变渗透压,导致细胞内的钙离子浓度升高,从而能激活钙蛋白酶,使其细胞膜胀裂,同时加速促使细胞凋亡物质的释放,增加细胞凋亡速度。25
治疗肺动脉高压
肺动脉高压(PAH)是肺动脉重构为特征和以肺动脉压力升高到一定界限的病理生理状态,可以是并发症或综合征。青蒿素用于治疗肺动脉高压:通过舒张血管降低PAH患者的肺动脉压力,改善症状。Zaiman等发现青蒿素具有抗炎作用,青蒿素及其内核物质对多种致炎因子有抑制作用,且还可以抑制炎性介质产生一氧化氮;青蒿素具有免疫调节作用;冯义柏等通过实验研究发现,青蒿素能够抑制血管内皮细胞、血管平滑肌细胞的增殖,进而在PAH的治疗过程中发挥着重要作用;青蒿素能够抑制基质金属蛋白酶的活性,从而抑制肺血管重构;青蒿素可以抑制PAH相关细胞因子的表达,进一步增强青蒿素抗血管重构作用。25
免疫调节
研究发现,青蒿素及其衍生物的使用剂量在不会引起细胞毒性的情况下,能够较好的抑制T淋巴细胞丝裂原,从而诱导小鼠脾脏淋巴细胞的增殖。这一发现对于治疗T淋巴细胞所介导的自身免疫性疾病,有很好的参考价值。青蒿玻醋具有增强非特异性免疫的作用,能够使小鼠血清的总补体活性提高。双氢青蒿素对于B淋巴细胞的增殖,能起到直接的抑制作用,从而减少B淋巴细胞对自身抗体的分泌,减轻体液免疫反应,对体液免疫有一定的抑制作用,减少了免疫复合物的形成。2728
抗真菌
青蒿素的抗真菌作用也使得青蒿素表现出了一定的抗菌活性。研究证实青蒿素的渣粉剂和水煎剂对炭疽杆菌、表皮葡萄球菌、卡他球菌、白喉杆菌均有较强的抑菌作用,对结核杆菌、绿脓杆菌、金黄色葡萄球菌、痢疾杆菌等也具有一定的抑菌作用。2930
抗糖尿病
2016年12月1日,《细胞》杂志上的一项研究表明,青蒿素或许还可以拯救糖尿病患者。来自奥地利科学院CeMM分子医学研究中心等机构的科学家发现,青蒿素能够让产生胰高血糖素的α细胞“变身”产生胰岛素的β细胞。青蒿素结合了一个称为gephyrin的蛋白。Gephyrin能够激活细胞信号的主要开关—GABA受体。随后,无数的生物化学反应发生变化,导致了胰岛素的产生。另一项研究表明,在小鼠模型中,注射GABA也能导致α细胞转化为β细胞,表明两种物质靶向了相同的机制,但青蒿素的长期作用需要进一步测试。31
分布情况
青蒿素主要是从青蒿中直接提取得到的,或提取青蒿中含量较高的青蒿酸,然后半合成得到的。青蒿虽然在世界各地广泛分布,但青蒿素含量随产地不同差异极大,具有显著的生态显著性。根据研究得知,除了中国部分地区外,世界绝大多数地区生产的青蒿中的青蒿素含量都很低,并无利用价值。32
检测方法
青蒿素检测的方法包括化学分析法、光谱分析法、色谱分析法、生物学方法等。33
|| || 青蒿素毒性实验数据
作用机理
与以往的抗疟药物不同,青蒿素抗疟机理的主要作用是通过对疟原虫表膜线粒体等的功能进行干扰,首先作用于食物泡膜、表膜、线粒体,其次作用于核膜、内质网,对核内染色质也有一定的影响,最终导致虫体结构的全部瓦解,而不是借助于干扰疟原虫的叶酸代谢。其作用机制也可能主要是干扰表膜—线粒体的功能,作用于食物泡膜,阻断营养摄取的最早阶段,使疟原虫较快出现氨基酸饥饿,从而迅速形成自噬泡并不断排出于虫体外,疟原虫最终损失大量细胞质而死亡。35
具体药理作用分两步:第一步是活化,青蒿素被疟原虫体内的铁催化,其结构中的过氧桥裂解,产生自由基;第二步是烷基化,第一步所产生的自由基与疟原虫蛋白发生络合,形成共价键,使疟原虫蛋白失去功能死亡。青蒿素无论在体内和体外的实验中均对疟疾有很好的杀灭效果。
青蒿素的作用机制尚不十分清楚,主要是干扰疟原虫的表膜-线粒体功能。青蒿素通过影响疟原虫红内期的超微结构,使其膜系结构发生变化。由于对食物泡膜的作用,阻断了疟原虫的营养摄取,当疟原虫损失大量胞浆和营养物质,而又得不到补充,因而很快死亡。其作用方式是通过其内过氧化物(双氧)桥,经血红蛋白分解后产生的游离铁所介导,产生不稳定的有机自由基及/或其他亲电子的中介物,然后与疟原虫的蛋白质形成共价加合物,而使疟原虫死亡。2015年,Wang等人利用化学蛋白质组学的技术手段合成了基于青蒿素结构的化学探针,准确的鉴定出了青蒿素在疟原虫中的100多个蛋白靶点,并且确定了青蒿素的激活依赖于疟原虫中生成的大量血红素。37
自由基的抗疟作用
青蒿素及其衍生物化学结构中的过氧桥这一基团是抗疟作用中最重要的结构。改变过氧基团,青蒿素的抗疟作用消失。青蒿素在体内活化后产生自由基,继而氧化性自由基与疟原虫蛋白质中的活性残基(例如半胱氨酸残基中的巯基)形成共价键,使蛋白失去功能导致疟原虫死亡。另一种观点认为青蒿素转化为碳自由基发挥烷化作用使疟原虫的蛋白烷基化。目前这一观点被广泛认可。
对红内期疟原虫的直接杀灭作用
青蒿素选择性杀灭红内期疟原虫是通过影响表膜-线粒体的功能,阻断宿主红细胞为其提供营养,从而达到抗疟的目的。同时青蒿素对疟原虫配子体具有杀灭作用。
抑制 PfATP6 酶的抗疟作用
有研究推测青蒿素及其衍生物对 PfATP6(Plasmodium falciparumcalcium ATPase 6)具有强大而特异的抑制效果。PfATP6 是恶性疟原虫基因组中唯一一类肌浆网/内质网钙ATP酶(sarco/endoplasmic reticulum calcium ATPase,SERCA)。青蒿素抑制 PfATP6,使疟原虫胞浆内钙离子浓度升高,引起细胞凋亡,从而发挥抗疟作用。
药典信息
基本信息
本品为(3R,5αS,6R,8αS,9R,12S,12αR)-八氢-3,6,9-三甲基-3,12-氧桥-12H-吡喃并[4,3-j]-1,2-苯并二氧杂环庚熳-10(3H)-酮,按干燥品计算,含C15H22O5应为98.0%~102.0%。
性状
本品为无色或白色针状结晶。
本品在丙酮、乙酸乙酯、三氯甲烷中易溶,在甲醇、乙醇、稀乙醇、乙醚及石油醚中溶解,在水中几乎不溶,在冰醋酸中易溶。
熔点
本品的熔点(通则0612第一法)为150~153 ℃。
比旋度
取本品,精密称定,加无水乙醇溶解并定量稀释制成每1 mL中含10 mg的溶液,依法测定(通则0621),比旋度为+75°至+78°。
鉴别
1、取本品约5 mg,加无水乙醇0.5 mL溶解后,加碘化钾试液0.4 mL,稀硫酸2.5 mL与淀粉指示液4滴,立即显紫色。
2、取本品约5 mg,加无水乙醇0.5 mL溶解后,加盐酸羟胺试液0.5 mL与氢氧化钠试液0.25 mL,置水浴中微沸,放冷后,加盐酸2滴和三氯化铁试液1滴,立即显深紫红色。
3、照薄层色谱法(通则0502)试验。
供试品溶液:取本品适量,加二氯甲烷溶解并稀释制成每1mL中约含3mg的溶液。
对照品溶液:取青嵩素对照品适量,加二氯甲烷溶解并稀释制成每1mL中约含3mg的溶液。
色谱条件:采用硅胶G薄层板,以石油醚(60~90℃)-乙醚(1:1)为展开剂。
测定法:吸取上述两种溶液各5 µL,分别点于同一薄层板上,展开,晾干,喷以茴香醛甲醇溶液(取冰醋酸10 mL与浓硫酸5 mL,缓缓加到55 mL甲醇中,放冷,将此溶液加入含有0.5 mL茴香醛的30 mL甲醇中,摇匀,避光保存),在110 ℃,加热3~5分钟使显色。
结果判断:供试品溶液所显主斑点的颜色和位置应与对照品







 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国