文章来源:“BTIT俱乐部”公众号

随着社会老龄化的深入发展,与衰老相关的疾病成为医学领域需要应对的重大挑战。在此背景下,清华大学药学院王建伟团队的最新研究引起了广泛关注,该研究聚焦于一种名为FUS的蛋白质,通过深入挖掘其异常相分离对造血干细胞衰老的影响,为解决衰老引发的一系列疾病提供了新的路径。本文将介绍这一科研成果,同时深入探讨其未来可能的临床应用前景。
研究背景
人体组织的衰老往往始于干细胞的老化,而造血干细胞(Hematopoietic Stem Cell, HSC)的健康直接关系到机体血液系统和免疫系统的稳定。造血干细胞衰老可以引发免疫缺陷、慢性髓系白血病、心脑血管疾病和多种慢性炎症疾病 (Dorshkind et al., 2009; Orkin and Zon, 2008)。因此,解析造血干细胞衰老的分子机制,能够为理解人类生理性衰老奠定理论基础,同时也为血液衰老相关疾病提供临床指导。
目前,针对疾病发病机制的理解仍存在显著的知识空缺,这极大限制了新治疗方法的开拓。为了突破这一困境,科学家们引入了新的概念,以便更全面地描述和理解人类疾病背后复杂的机制。多项研究表明,**异常的蛋白质凝聚物与多种人类疾病存在关联,**包括癌症、神经退行性疾病以及传染病等(Alberti and Dormann, 2019)。科学家通过对异常形式凝聚物驱动疾病发生机制的研究,为理解和对抗一些严重疾病提供了新的研究框架。
近年来,科学家们发现了一种广泛存在于细胞内的生物学现象——相分离,这一现象在精确调控蛋白质的定位、反应和稳定性方面发挥着关键作用(Lyon et al., 2020; Woodruff et al., 2017)。研究发现,许多蛋白质通过“相分离”来执行其功能,以维持机体正常的生命活动。然而,当蛋白质的“相分离”出现异常时,可能导致功能的紊乱,从而引发机体的病变。尽管目前对于异常相分离与造血干细胞衰老之间的关联和作用机制尚不清晰,但这一领域的研究正为揭开这一生物学谜团提供着新的方向和动力。
近日,清华大学药学院王建伟团队在 Blood 发表了题为Aging-disturbed FUS Phase Transition Impairs Hematopoietic Stem Cell by Altering Chromatin Structure的文章。清华大学药学院王建伟教授、清华大学医学院师明磊教授和张奇伟教授为共同通讯作者。团队成员唐白雪、王新铭为共同第一作者。该研究以FUS(是一种蛋白质,与 RNA 结合并参与多种细胞过程)的异常相分离作为切入点,来探讨其对造血干细胞的影响以及可能的生物学机制,阐述了异常相分离与血液系统衰老的因果关系。

研究过程和发现
研究实施过程中,该团队系统性开展从FUS表达量对造血干细胞功能的标记作用,到FUS异常相分离调控三维基因组和转录谱的机制研究。研究发现,FUS的异常相分离与造血干细胞衰老紧密相连。具体而言,异常相分离导致FUS无法正确与染色质结合,使得造血干细胞的三维染色质结构变得混乱,关键基因的调控受到影响,最终导致造血干细胞呈现早衰表型。
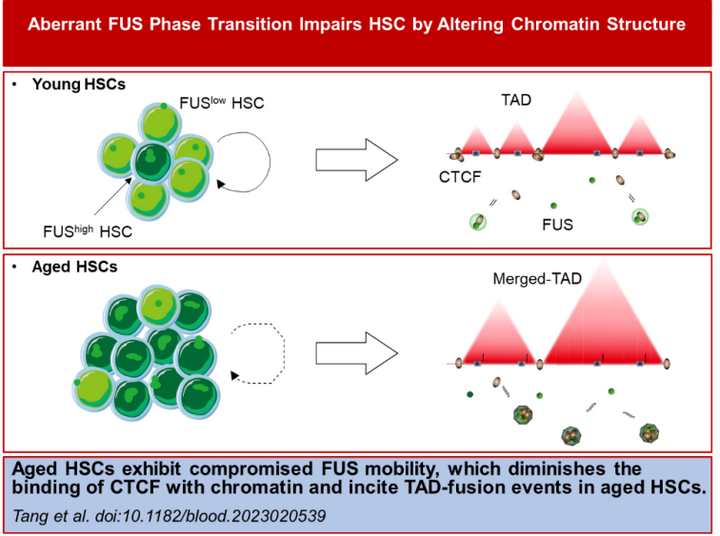
这项研究不仅阐明了FUS相分离在造血干细胞衰老中的关键生物学功能,同时首次揭示了衰老造血干细胞三维基因组结构的变化,为生理性衰老染色质调控研究奠定理论基础。
尤其值得注意的是,研究团队发现,通过干预FUS的表达,可以有效逆转衰老造血干细胞的功能,延缓血液系统的衰老。因此,干预异常相分离可能成为调控血液系统衰老以及治疗与衰老相关的疾病的重要方法。这项研究也为延缓血液系统衰老和防治衰老相关血液疾病提供了有益的指导。
应用前景
这项研究不仅有助于深入了解衰老过程,为未来治疗衰老相关疾病提供了希望。以下是该研究可能的未来临床应用前景:
1.干预衰老造血干细胞功能
通过干预FUS的表达,研究团队成功逆转了衰老造血干细胞的功能。这一发现提供了新的治疗思路,有望延缓或逆转衰老造血干细胞功能下降。未来,这可能成为一种针对老年人群的干预手段,延缓衰老过程,提高机体免疫功能。
2.治疗与衰老相关的疾病
由于造血干细胞衰老可能导致多种与衰老相关的疾病,该研究的结果为这些疾病的治疗提供了新的方向。通过干预FUS相分离,有望干扰这些疾病的发展和进展,为患者提供更有效的治疗手段。这可能包括免疫缺陷、慢性髓系白血病、心脑血管疾病和慢性炎症疾病等。
3.个性化治疗与临床指导
研究结果的临床应用还可能包括个性化治疗和临床指导。通过了解FUS相分离的具体作用,医生可以更精准地干预造血干细胞的功能,为每位患者制定个性化的治疗方案。这种精准医疗的方法将为未来医疗提供更多选择,提高治疗效果。
未来挑战与展望
尽管这一研究结果令人振奋,但要将其成功地应用于临床,还需要面临一系列挑战。其中包括大规模人群的验证研究、安全性和有效性的进一步确认,以及潜在的治疗方法的开发。研究团队将继续努力,以克服这些挑战,为这一发现的实际应用打下坚实的基础。
参考资料
[1] Dorshkind, K., Montecino-Rodriguez, E., and Signer, R.A. (2009). The ageing immune system: is it ever too old to become young again? Nat Rev Immunol 9, 57-62.
[2] Orkin, S.H., and Zon, L.I. (2008). Hematopoiesis: An Evolving Paradigm for Stem Cell Biology. Cell 132, 631-644.
[3] Alberti, S., and Dormann, D. (2019). Liquid–Liquid Phase Separation in Disease. Annual Review of Genetics 53, 171-194.
[4] Lyon, A.S., Peeples, W.B., and Rosen, M.K. (2020). A framework for understanding the functions of biomolecular condensates across scales. Nature Reviews Molecular Cell Biology.
[5] Woodruff, J.B., Hyman, A.A., and Boke, E. (2017). Organization and Function of Non-dynamic Biomolecular Condensates. Trends in Biochemical Sciences 43, 81-94.
撰文:小鱼
审核:淑霞
排版:楚涵
投稿合作:chuhan.si@shulanfund.com






 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国