
前言概述
/ CONTENTS
学科新知聚焦业内权威专家,从学科发展的高度全面梳理、深入解读肿瘤医学各领域的国内外研究现状与进展,为医护以及科研人员立体勾勒恶性肿瘤领域的最新研究进展,赋能临床科研和学术推广,为医学研究者搭建一个共享知识、交流经验的平台,推动肿瘤医学领域的国际化合作与发展。
本期学科新知分享的是苏州大学附属第二医院李炳宗教授对淋巴瘤cfDNA诊断和预后预测进展的精彩解读。
1
cfDNA的临床应用现状
活检,是“活体组织检查”简称,亦称外科病理学检查,是指应诊断、治疗的需要,从患者体内切取、钳取或穿刺等取出病变组织,进行病理学检查的技术。活检是诊断病理学中最重要的部分,对绝大多数送检病例都能做出明确的组织病理学诊断,被作为临床的最后诊断。在恶性肿瘤的诊疗中,影像学检查,如CT扫描或MRI,有助于检测肿块或不规则组织,但仅凭这些检查无法区分癌性细胞和非癌性细胞。病理诊断则被公认为恶性肿瘤诊断的“金标准”,在此过程中,活检是必不可少的步骤。
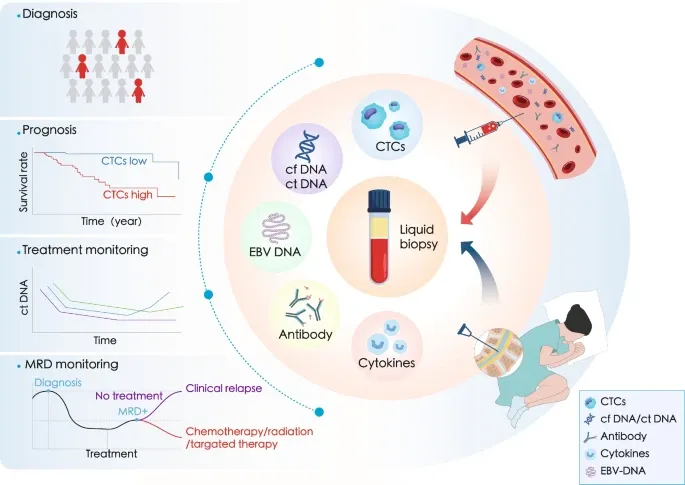
液体活检,也称为液态活检或液相活检,指以体液为检材获得肿瘤生物信息的体外诊断技术。可用于液体活检的体液包括血液、尿液、粪便、脑脊液、唾液、胸腔或腹盆腔积液等,检测对象主要有游离核酸、肿瘤细胞、细胞外囊泡、血小板等。
人体细胞凋亡和坏死后会释放片段化DNA到体液中,称为游离DNA(cfDNA)。cfDNA长度主要分布在一个核小体的范围内,长度约为166 bp,其次分布于300 bp(双核小体)和500 bp(三核小体)范围。cfDNA的半衰期很短,约为30 min~2 h,其含量的变化可以更实时地反映肿瘤负荷[1]。在健康人群正常器官组织来源的cfDNA中,淋巴样细胞和髓样细胞的脱落DNA所占比例最大。在cfDNA中,部分来自肿瘤细胞的DNA则被称为循环肿瘤DNA(ctDNA)。ctDNA会携带来源于肿瘤细胞相关的遗传学特征,如基因突变、甲基化、扩增或重排等,可作为肿瘤筛查、伴随诊断、治疗疗效评估及预后风险分层的重要指标。
在健康人血清中,cfDNA的含量为0~100 ng/ml,平均约为30 ng/ml,而肿瘤患者血清中的含量差异较大,在0~1000 ng/ml,平均约为180 ng/ml。基于此,血液cfDNA含量的检测对于肿瘤早期诊断和治疗后监测具有显著价值。国内首个前瞻性、盲法、独立验证研究(THUNDER)发现在肺癌、肠癌、肝癌、卵巢癌、胰腺癌和食管癌6大癌种中基于cfDNA的液体活检在癌症早筛的独立验证中可达到98.9%的特异性、69.1%的敏感性以及83.2%的组织溯源准确性。在真实世界模拟中实现了70.6%的灵敏度,可将晚期发病率降低38.7%-46.4%,五年生存率提高33.1%-40.4%[2]。
淋巴瘤是一类起源于淋巴系统的恶性肿瘤,包括霍奇金淋巴瘤(HL)和非霍奇金淋巴瘤(NHL)。目前诊断淋巴瘤和评估肿瘤生物学特征仍然主要依赖于病变组织的组织病理活检。然而组织病理活检有些情况下面临着取材困难的问题,而影像学评估始终面临敏感性不足和对肿瘤负荷精确定量困难的难题。此外,基于PHOENIX和RUBUST研究的失败结果,也表明基于细胞起源的病理分型无法准确指导靶向药物的治疗,而根据基因分型及相关的信号通路异常来指导各种分子靶向药物在淋巴瘤治疗中的应用是有临床价值的[3,4]。
国外的一项使用cfDNA甲基化特征在多癌种的检测与定位的研究开发了用于癌症检测和组织起源定位的分类器,发现其在验证集中特异性可达99.3%,假阳性率为0.7%。检测率随着分期的增加而增加:在预先指定的癌症类型中,Ⅰ期敏感性为39%,Ⅱ期敏感性为69%,Ⅲ期为83%,Ⅳ期为92%。在所有癌症类型中,Ⅰ期敏感性为18%,Ⅱ期敏感性为43%,Ⅲ期敏感性为81%,Ⅳ期为93%。在淋巴瘤中,训练集的敏感性在Ⅰ期(n=15)约为23%,Ⅱ期(n=28)约为75%,Ⅲ期(n=27)约为78%,Ⅳ期(n=39)约为80%;验证集的敏感性在Ⅰ期(n=7)约为60%,Ⅱ期(n=12)约为100%,Ⅲ期(n=12)约为85%,Ⅳ期(n=39)约为100%。此外,通过混淆矩阵表示训练集和验证集中组织溯源的准确性,发现在淋巴瘤中,训练集具有高达92%的准确率,同时,验证集中的准确性也可达85%。因此,基于cfDNA信息甲基化模式的测序在转移性和非转移性阶段检测中的特异性及敏感性可接近人群水平筛查的目标[5]。
综合上述研究结果,基于cfDNA的检测方法具有特异性高、敏感性高等特性。非侵入性的检测方式也为患者提供诸多便利。
2
cfDNA在常见淋巴瘤诊断和预后预测中的价值
淋巴瘤在原发肿瘤内和跨疾病部位都表现出空间异质性。随着时间的推移和治疗压力的影响,克隆选择和进化可导致额外的临床相关异质性。因此,单次活检可能无法反映疾病生物学的全部。由于cfDNA包含从所有疾病部位脱落的分子,因此该检测可以更准确地描述相关突变。此外,在解剖学困难的部位,如中枢神经系统(CNS)淋巴瘤或放射学上隐匿性疾病中可能无法进行活检。虽然切除活检仍然是“金标准”,但液体活检方法可能在诊断和复发的基因分型中发挥越来越重要的作用。
在弥漫性大B细胞淋巴瘤(DLBCL)中,一项从游离DNA片段谱推断基因表达的研究当中,通过基于cfDNA片段特征开发了表观遗传表达推断(EPIC-seq)分析方法。通过EPIC-seq技术对DLBCL患者的预处理血液样本进行分析检测cfDNA中的表观遗传信号,从而非侵入性地识别DLBCL病例,并区分癌症患者与健康对照者。在训练集中,此技术在区分DLBCL患者(n=91)和非癌症对照者(n=71)时表现出强大的性能(AUC=0.92)。在应用于DLBCL患者(n=23)和非癌症对照参与者(n=23)的验证队列时,观察到在区分癌症和非癌症方面有相似的表现(AUC=0.96)。在治疗期间,患者的EPIC-seq评分显示出与ctDNA浓度随时间变化的强烈且显著的相关性,表明依据cfDNA可以无创地检测组织来源的DLBCL信号,并真实反映DLBCL治疗前后的疾病负担。在DLBCL的亚型分类中,基于EPIC-seq分析的结果可明显区分GCB亚型与ABC亚型,相比于Hans算法,此类无创分类方法可更好地对患者进行分型[6]。
此外,国外学者也通过定向变异(PVs)富集和检测测序(PhasED-seq)的方法,通过测定单个DNA片段中的多个体细胞突变来提高ctDNA检测灵敏度,发现其在治疗期间和复发之前都能有效提高临床样本的ctDNA阳性检测率,且能应用于实体瘤患者。从三个独立的DLBCL患者的全基因组测序(WGS)中识别可能存在的PVs并追踪残留病灶,结果表明,PhasED-seq检测出的单核苷酸变异(SNV)和PVs的数量有显著提高。在比较PhasED-seq与其他ctDNA检测方法(CAPP-seq或双链测序)中,研究团队将三名淋巴瘤患者中提取出ctDNA并将其稀释到健康对照cfDNA中,结果表明PhasED-seq的测序错误率更低且对ctDNA的检测率显著提高。通过对一名接受治疗的DLBCL患者的cfDNA测序进行检测实用性应用,发现CAPP-seq仅在患者经过一个周期的治疗后就无法检测到ctDNA,经250天后可检测出,五个月后患者便出现了临床疾病进展。与此相反的是通过CAPP-seq检测不到的ctDNA可由PhasED-seq检出,大大提前了ctDNA的检测时间。随后,研究团队进一步评估了phasED-seq在107名接受标准免疫化疗的B细胞淋巴瘤患者中的表现,结果也都表明PhasED-seq检测ctDNA的优越性[7]。
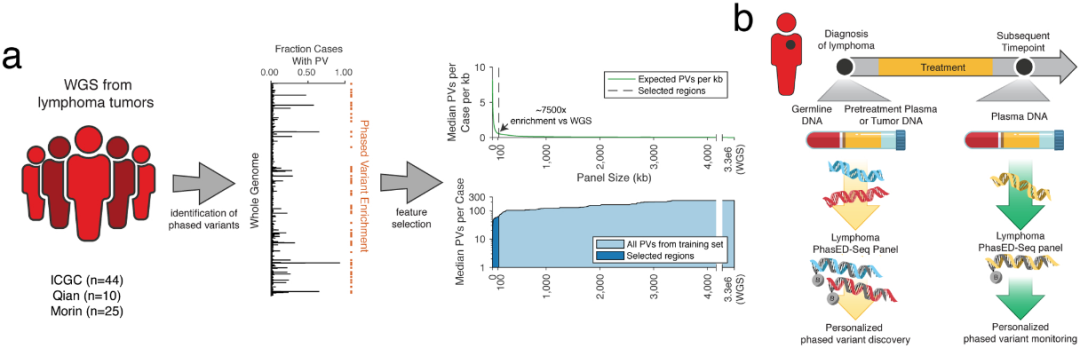
在经CAR-T治疗后失败的大B细胞淋巴瘤患者中,通过cfDNA的低通全基因组测序(lpWGS)以确定DNA拷贝数改变(CNA)。表示基因组不稳定性的高局灶性CNA评分(FCS)在多变量选择中,是与较差的3个月完全缓解率、无进展生存期和总生存期相关的最重要的预处理变量。研究共在89%(108/122)患者中发现34个独特的局灶性CAN。其中,导致FAS死亡受体丧失的10q23.3缺失与不良结局的相关性最高,导致PFS和OS较差。研究还发现高FCS与超过1个淋巴结外病变部位相关,但与反映肿瘤体积增加的疾病特征,例如乳酸脱氢酶(LDH)升高不存在关联。基于此发现,团队构建了包含高FCS、升高的LDH和>1淋巴结外位点的风险分层模型,发现此模型可以识别出CRA-T治疗后12个月时PFS仅为4%的高风险患者组[8]。
在套细胞淋巴瘤(MCL)中,对于37名复发/难治性B细胞淋巴瘤患者(18名MCL患者)联合使用BTK抑制剂(ibrutinib)和泛PI3K抑制剂(buparlisib)治疗进行了一项单中心Ⅰ/Ⅰb期试验,并在之后进行cfDNA样本的连续监测。研究发现,血浆ctDNA突变与肿瘤突变高具有度一致性。在MCL患者样本中,在基线血浆样本中检测到患者携带MSI1 N247S和TET2 H877L突变,而在该患者的肿瘤样本中未发现这些突变。此外,在可检测到ctDNA的MCL患者中,ctDNA的变化与患者的治疗响应和疾病进展紧密相关,并且在部分复发患者中,ctDNA的增加先于影像学上的复发迹象。ctDNA的动态变化能够反映肿瘤负荷和预测复发,揭示疾病进展的早期信号,在监测治疗效果和疾病演变方面具有敏感性。耐药性检测方面,血浆ctDNA测序揭示了治疗过程中可能出现的耐药性突变,早于影像学进展[9]。
T细胞淋巴瘤是一种高度侵袭性的肿瘤,具有显著的异质性。在血管免疫母细胞亚型中,ctDNA中的G17V RHOA突变被证明在预测肿瘤DNA突变状态方面具有100%的敏感性和特异性[10]。在结外NK/T细胞淋巴瘤亚型中,配对基线肿瘤组织和cfDNA的基因分型结果之间具有一致性,cfDNA浓度较低时患者具有更好的生存结果[11]。另一项研究也显示治疗后未检测到ctDNA的患者的完全缓解率高于治疗后持续检测到ctDNA的患者[12]。cfDNA/ctDNA在淋巴瘤治疗后微小残留病灶(MRD)评估中也具有极大的潜力。在检测同种异体造血干细胞移植的淋巴瘤患者中MRD的存在与复发/进展之间的关联的研究中,84%(16/19)患者在复发/进展前3.7个月内检测到了ctDNA。同ctDNA阴性患者相比,同种异体造血干细胞移植后三个月可检测到ctDNA的患者的无进展生存率较低。因此基于ctDNA的检测在T细胞淋巴瘤的诊断、预后、治疗反应评估和MRD评估中都发挥着至关重要的作用[13]。
大多数经典霍奇金淋巴瘤患者要么治疗过于集中而遭受不必要的副作用,要么治疗不够集中而出现复发,因而个体化治疗在改善治疗结果及减少副作用方面十分必要。在个体化治理策略中可通过准确的风险评估进行预先治疗,或准确评估治疗反应以在治愈后立即停止治疗。国外学者团队基于此设计一个有针对性的ctDNA测序和生物信息学平台,以期在随访期间进行准确的基线基因分型和MRD检测。团队发现cfDNA的检测可在0.5%的突变等位基因频率(mAF)下实现高度敏感和特异的突变检测。该技术能可靠地区分出低至0.025% mAF的MRD。临床验证阶段,通过比对cfDNA样本中的检测到的变异与活检样本相比,可确认所有mAF大于4%的突变(26/26)和91.3%的所有突变(63/69)。对于拷贝数评估,研究将cfDNA中9p24.1区域(PD-L1基因所在位置)的增益与荧光原位杂交(FISH)这一金标准进行了对比,二者之间存在强相关性,显示出cfDNA在检测诊断中的巨大潜力[14]。
cfDNA在淋巴瘤中的应用不仅增强了疾病的分子层面理解,也为患者提供了更加精准的治疗监测和管理手段,是推动淋巴瘤个体化医疗向前发展的重要工具。
3
中国智慧助力cfDNA光明未来
在2023年第65届美国血液学会(ASH)年会中,一项“脑脊液和血浆循环游离DNA在新诊断弥漫性大B细胞淋巴瘤中的诊断和预后价值”成功入选口头报告环节,展示了中国学者在此领域的探索与创新[15]。
研究入组了43例DLBCL患者(更大样本的检测和验证还在进行中),32例患者血浆cfDNA检测出基因突变,阳性率达到74%(32/43),远高于外周血基因组DNA检测出的阳性率(16%)。其中,28/39(72%)例患者肿瘤组织和血浆cfDNA结果一致,均为阳性。较高的一致性有助于精确诊断和MRD监测。此外,4例患者无法获取肿瘤组织,但cfDNA检测为阳性。这也体现出cfDNA辅助诊断对于血管内大B细胞淋巴瘤或者其他采样困难患者的重要性。
相较于骨髓或原发病灶组织,14/28(50%)例患者血浆cfDNA中检测出更多突变,更好地反映了肿瘤的异质性。7/30例患者脑脊液cfDNA检测出阳性,其中,3例患者有明确中枢侵犯证据,4例患者脑脊液暂时无细胞学、流式或影像学异常证据。可以看出,cfDNA阳性结果可能作为一种预测早期中枢复发的生物标志物。目前,我们也在密切观察这些患者的临床状态。
此外,利用多功能检测套组同时检测出点突变(SNV/Indel)、基因拷贝数变异(CNV)、Ig相关融合及克隆性免疫球蛋白基因重排,对于提高cfDNA阳性检出率,进一步探讨DLBCL分子机制以及协助临床诊断、治疗和预后评估都具有非常重要的意义。
淋巴血液病理专业诊断医技人员短缺,实验室建设、质量控制和专业人员培训水平参差不齐,一定程度上影响了我国淋巴瘤精准诊治前进的步伐。为实现“千变万化”的淋巴瘤诊疗工作规范化和同质化,苏州大学附属第二医院血液科依据CACA指南进行了试点和改革。作为江苏省临床重点专科和苏州大学附属第二医院淋巴瘤中心依托单位,该科室依据“MDT to HIM”理念,联合病理科、影像科、核医学科和放疗科等多个学科组建淋巴瘤MDT团队和CAR-T细胞MDT团队,致力于淋巴瘤的规范化和精准化整合诊治。相关建设成果于2023年8月获批全国第一批国家淋巴瘤规范诊疗质量控制试点单位。未来,地方性淋巴瘤诊疗机构将主要依托国家级淋巴瘤病理中心基地开展继续教育与专业人才培训工作,致力于将淋巴瘤诊疗规范化、同质化。国家级淋巴瘤病理中心和国家级淋巴瘤临床诊疗中心直接对接,建立完整的技术平台和相对充分的医疗、师资人力资源和教学、科研条件十分重要。近年来多组学研究为淋巴瘤的诊疗提供了诸多新思路,通过研究DNA、RNA、蛋白质、表观遗传和代谢产物等的构成以及在特定条件下这些组分间的相互作用和关系,融合分析寻找精准的诊疗靶点,结合预测模型筛选高危患者,最终实现精准分层的个体化治疗模式使患者获益。而这些先进技术的开展与落地临床是未来5年发展的重中之重。
中国抗癌协会组织权威专家编写完成并发表的《CACA指南-淋巴瘤》反映了我国淋巴瘤治疗领域的最新进展,整合了国内外淋巴瘤诊疗领域最好的循证医学证据和临床经验,将深入指导中国淋巴瘤规范化、正规化诊断,促进治疗水平的提升。

参考文献(向上滑动阅览)
[1]樊代明. 中国抗癌协会. 中国肿瘤整合诊治指南(CACA), 2022.
[2]Gao Q, Lin YP, Li BS, et al. Unintrusive multi-cancer detection by circulating cell-free DNA methylation sequencing (THUNDER): development and independent validation studies. Ann Oncol. 2023;34(5):486-495. doi:10.1016/j.annonc.2023.02.010
[3]Younes A, Sehn LH, Johnson P, et al. Randomized Phase III Trial of Ibrutinib and Rituximab Plus Cyclophosphamide, Doxorubicin, Vincristine, and Prednisone in Non-Germinal Center B-Cell Diffuse Large B-Cell Lymphoma. J Clin Oncol. 2019;37(15):1285-1295. doi:10.1200/JCO.18.02403
[4] Nowakowski GS, Chiappella A, Gascoyne RD, et al. ROBUST: A Phase III Study of Lenalidomide Plus R-CHOP Versus Placebo Plus R-CHOP in Previously Untreated Patients With ABC-Type Diffuse Large B-Cell Lymphoma. J Clin Oncol. 2021;39(12):1317-1328. doi:10.1200/JCO.20.01366
[5] Liu MC, Oxnard GR, Klein EA, Swanton C, Seiden MV; CCGA Consortium. Sensitive and specific multi-cancer detection and localization using methylation signatures in cell-free DNA. Ann Oncol. 2020;31(6):745-759. doi:10.1016/j.annonc.2020.02.011
[6] Esfahani MS, Hamilton EG, Mehrmohamadi M, et al. Inferring gene expression from cell-free DNA fragmentation profiles. Nat Biotechnol. 2022;40(4):585-597. doi:10.1038/s41587-022-01222-4
[7] Kurtz DM, Soo J, Co Ting Keh L, et al. Enhanced detection of minimal residual disease by targeted sequencing of phased variants in circulating tumor DNA. Nat Biotechnol. 2021;39(12):1537-1547. doi:10.1038/s41587-021-00981-w
[8] Cherng HJ, Sun R, Sugg B, et al. Risk assessment with low-pass whole-genome sequencing of cell-free DNA before CD19 CAR T-cell therapy for large B-cell lymphoma. Blood. 2022;140(5):504-515. doi:10.1182/blood.2022015601
[9] Stewart CM, Michaud L, Whiting K, et al. Phase I/Ib Study of the Efficacy and Safety of Buparlisib and Ibrutinib Therapy in MCL, FL, and DLBCL with Serial Cell-Free DNA Monitoring. Clin Cancer Res. 2022;28(1):45-56. doi:10.1158/1078-0432.CCR-21-2183
[10] Sakata-Yanagimoto M, Nakamoto-Matsubara R, Komori D, Nguyen TB, Hattori K, Nanmoku T, Kato T, Kurita N, Yokoyama Y, Obara N, Hasegawa Y, Shinagawa A, Chiba S. Detection of the circulating tumor DNAs in angioimmunoblastic T- cell lymphoma. Ann Hematol. 2017 Sep;96(9):1471-1475. doi: 10.1007/s00277-017-3038-2. Epub 2017 Jun 20. PMID: 28634614.
[11] Qi F, Cao Z, Chen B, Chai Y, Lin J, Ye J, Wei Y, Liu H, Han-Zhang H, Mao X, Feng X, Dong M. Liquid biopsy in extranodal NK/T-cell lymphoma: a prospective analysis of cell-free DNA genotyping and monitoring. Blood Adv. 2021 Jun 8;5(11):2505-2514. doi: 10.1182/bloodadvances.2020001637. PMID: 34047776; PMCID: PMC8238484.
[12] Qi F, Cao Z, Chen B, Chai Y, Lin J, Ye J, Wei Y, Liu H, Han-Zhang H, Mao X, Feng X, Dong M. Liquid biopsy in extranodal NK/T-cell lymphoma: a prospective analysis of cell-free DNA genotyping and monitoring. Blood Adv. 2021 Jun 8;5(11):2505-2514. doi: 10.1182/bloodadvances.2020001637. PMID: 34047776; PMCID: PMC8238484.
[13] Huang Z, Fu Y, Yang H, et al. Liquid biopsy in T-cell lymphoma: biomarker detection techniques and clinical application. Mol Cancer. 2024;23(1):36. Published 2024 Feb 17. doi:10.1186/s12943-024-01947-7
[14] Sobesky S, Mammadova L, Cirillo M, et al. In-depth cell-free DNA sequencing reveals genomic landscape of Hodgkin's lymphoma and facilitates ultrasensitive residual disease detection. Med. 2021;2(10):1171-1193.e11. doi:10.1016/j.medj.2021.09.002
[15] https://ash.confex.com/ash/2023/webprogram/Paper178196.html




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国