
前言概述
/ CONTENTS
学科新知聚焦业内权威专家,从学科发展的高度全面梳理、深入解读肿瘤医学各领域的国内外研究现状与进展,为医护以及科研人员立体勾勒恶性肿瘤领域的最新研究进展,赋能临床科研和学术推广,为医学研究者搭建一个共享知识、交流经验的平台,推动肿瘤医学领域的国际化合作与发展。
本期学科新知分享的是南通大学附属医院林赠华教授和刘红教授对继发性的中枢神经淋巴瘤诊疗进展的精彩解读。
继发性中枢神经系统淋巴瘤(SCNSL)定义为全身性淋巴瘤初始诊断时或复发时累及中枢神经系统(CNS),可以是孤立的也可以是同步的全身性疾病。本文将回顾继发性中枢神经淋巴瘤诊疗的重磅学科进展,展望未来临床探索方向,共同推进中国淋巴瘤临床治疗事业的发展!
1
临床进展——靶向药
SCNSL的发病率约为非霍奇金淋巴瘤(NHL)4%~6%,尽管发病率低,但是患者的预后情况通常都不容乐观。据统计,SCNSL患者的中位生存时间仅为5个月。值得注意的是,SCNSL在初次被诊断后的第一年内,往往会有首次复发的风险[1]。正是由于大多数患者在治疗后不久仍会进展或复发,这使得SCNSL的治疗和管理变得尤为复杂和艰难。然而,近些年来关于SCNSL的预防与诊治方面的研究取得了显著进展,研究人员们不断探索新的治疗策略,免疫调节性药物、靶向治疗药物等新型药物或治疗方法逐渐展现出其巨大的潜力和价值。这些新型药物或治疗方法的出现,为SCNSL患者带来了新的希望。
SCNSL以弥漫性大B细胞淋巴瘤(DLBCL)最为常见,利妥昔单抗联合化疗(R-CHOP)成为DLBCL标准一线治疗方案后,一定程度上降低了SCNSL的发生率,但降低的幅度相对有限,统计学差异尚不显著,这可能与利妥昔单抗的血脑屏障通过率较低有关。
2019年1月,为期六年的HOVON 105/ALLG NHL 24研究结果发表在The Lancet Oncology,不支持利妥昔单抗加入以甲氨蝶呤为基础的原发性中枢神经系统淋巴瘤标准治疗(MBVP)。但该研究的一个亚组分析显示,对于年龄小于60岁(有资格接受巩固性全脑放疗)的患者中,R-MBVP治疗相比MBVP治疗对患者EFS的影响具有统计学显著差异(P=0.015)。该计划外亚组分析需要被谨慎解读,研究者认为虽然利妥昔单抗并非与全脑放疗同时给予,但其可在血清中持续存在长达9个月,可能在全脑放疗破坏血脑屏障后渗透到大脑中从而发生作用。具体原因仍需一项新的以OS为主要终点、检验60岁以下患者差异的随机Ⅲ期研究[2]。
另一项INGRID单臂Ⅱ期研究,利用NGR-hTNF-α靶向CD13+肿瘤血管,选择性地增加了原发性中枢神经系统淋巴瘤和肿瘤周围区域的血管通透性,在12名评估患者中有9例患者对NGR-hTNF/R-CHOP联合治疗具有良好的耐受性,肿瘤消退迅速且明显[3]。
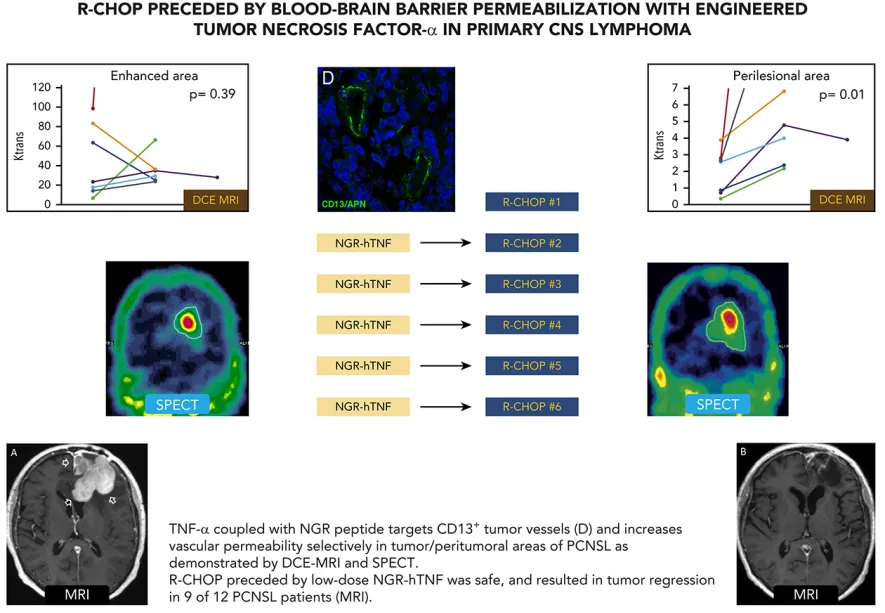
图1 INGRID研究[3]
上述原发性中枢神经系统淋巴瘤中的临床研究为部分原本透过血脑屏障较差的药物在治疗继发性中枢神经系统淋巴瘤患者时起效的机制提供了一些启发,血脑屏障的破坏以及药物对全身原发灶的有效控制是这些药物对颅内转移灶生效的可能原因。
SCNSL通常以急性神经症状为特征,因此一旦出现,必须立即进行紧急治疗。血脑屏障阻止了很多药物渗透到中枢神经系统中,为了有效地治疗SCNSL,医生需要选择那些能够通过血脑屏障的药物,以确保药物能够进入中枢神经系统并发挥治疗作用。
01
免疫调节性药物
● 来那度胺
来那度胺是免疫调节性药物,能够抑制TNF-α、IL-1、IL-6及IL-12的分泌,促进IL-10分泌,诱导肿瘤细胞凋亡,激活肿瘤微环境中T细胞和NK细胞活性,发挥免疫调节的抗肿瘤作用,当其与R-CHOP联合使用时,可以发挥预防中枢神经系统复发的作用[4]。
在一项对136例Ⅱ期临床试验患者的回顾性分析中,研究者发现来那度胺联合R-CHOP(R2CHOP)治疗DLBCL(弥漫性大B细胞淋巴瘤)的中枢神经系统复发率明显低于预期。该研究将这些患者分为低、中、高CNS-IPI风险组,Kaplan-Meier法估计R2CHOP队列的2年中枢神经系统复发率为0.9%,低、中、高风险组分别为0%、0%和5.0%。与MER数据库中接受R-CHOP治疗的DLBCL患者相比,R2CHOP队列的2年总体中枢神经系统复发率较低(0.9% vs. 1.8%),这一数据充分展示了该联合治疗方案在预防中枢神经系统复发方面的显著优势[5]。
在另一项Ⅰ期试验中,研究者对14例难治性CD20+ CNSL患者(其中5例SCNSL-DLBCL患者)应用来那度胺单药治疗,部分患者加用利妥昔单抗和(或)地塞米松,最终9例来那度胺单药治疗的患者达到了至少部分缓解,6例维持缓≥9个月,4例维持缓解≥18个月,来那度胺维持相较于标准疗法缓解时间明显延长。此外,该试验还深入探讨了脑脊液乳酸水平在复发性中枢神经系统淋巴瘤中的预后意义。研究发现,脑脊液乳酸升高的复发性中枢神经系统淋巴瘤患者的总生存期明显缩短。对于接受来那度胺单药治疗的复发性中枢神经系统淋巴瘤患者而言,高脑脊液乳酸水平也与较短的无进展生存期相关。这一发现可能为鉴别可能受益于来那度胺的中枢神经系统淋巴瘤患者提供了有价值的参考依据[6]。
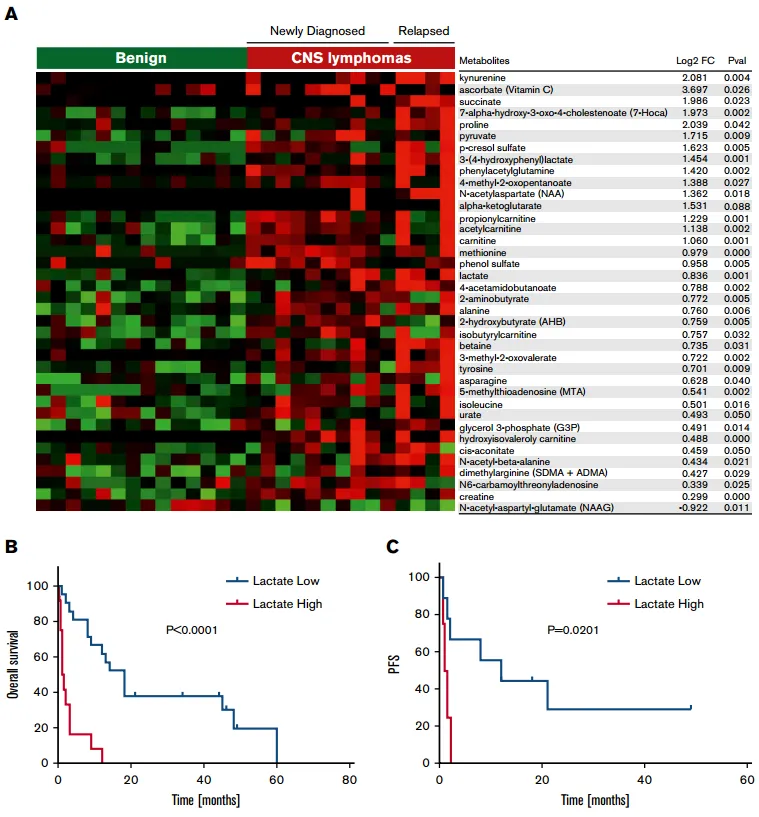
图2 脑脊液乳酸水平在复发性中枢神经系统淋巴瘤中的预后意义[6]
● 泊马度胺
泊马度胺是第三代免疫调节剂,具有直接的细胞毒性和免疫调节作用,能抑制血液肿瘤细胞增殖,诱导其凋亡。泊马度胺与地塞米松联用可协同诱导对来那度胺敏感或耐药的肿瘤细胞凋亡[7]。
一项Ⅰ期临床研究评估了在复发难治PCNSL或PVRL患者中应用泊马度胺联合地塞米松的安全性和疗效。最终确定泊马度胺最大耐受剂量(MTD)为5mg。在25例可评估疗效的患者中,ORR为48%;16例MTD组患者ORR为50%。总体中位无进展生存(mPFS)时间为5.3个月,出现缓解的患者mPFS时间为9个月。3~4级血液学不良反应主要包括中性粒细胞减少(21%)、贫血(8%)、血小板减少(8%)[8]。泊马度胺也因此被美国国立综合癌症网络(NCCN)指南推荐用于复发难治PCNSL患者[9]。
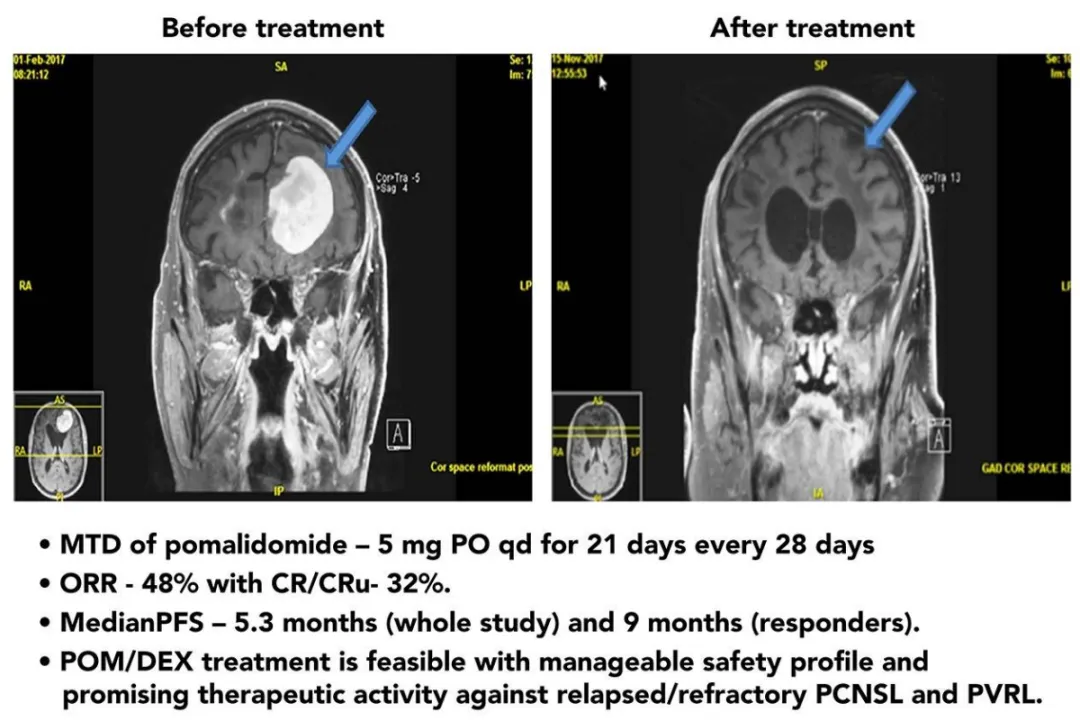
图3 泊马度胺联合地塞米松达到CR的PCNSL患者的脑MRI[8]
泊马度胺在PCNSL治疗中的成功经验为SCNSL治疗提供了宝贵的启示。尽管SCNSL与PCNSL在病理和临床表现上有所不同,但泊马度胺的药理特性和临床研究结果显示,其在中枢神经系统淋巴瘤治疗中的潜力不容忽视。未来,需要更多的临床研究来验证泊马度胺在SCNSL中的疗效和安全性,以期为患者提供更多的治疗选择,改善预后。
02
靶向药物
● BTK抑制剂
近年来,BTK抑制剂在SCNSL的治疗领域中备受关注。伊布替尼作为一种创新的小分子抑制剂,以其独特的药理机制在SCNSL的治疗中展现出了显著的潜力。伊布替尼能够与Bruton酪氨酸激酶(BTK)的活性位点Cys-481高效结合,抑制其活性。伊布替尼可透过血脑屏障,动物模型及临床试验皆证实颅脑中伊布替尼的血药浓度可达到有效浓度,在SCNSL中可能存在血脑屏障破坏,这将进一步增强伊布替尼治疗SCNSL的疗效[10]。
PHOENIX Ⅲ期试验比较了R-CHOP联合伊布替尼与R-CHOP治疗DLBCL的疗效。研究结果显示,在年龄小于60岁的患者中,伊布替尼联合R-CHOP改善了EFS(HR,0.579)、PFS(HR,0.556)和OS(HR,0.330)。研究还发现,在接受R-CHOP联合伊布替尼治疗的患者中,中枢神经系统复发率为2.4%,而接受R-CHOP治疗的患者复发率为3.8%[11]。
此外,Grommes等在一项Ⅱ期临床试验中,对44例复发难治性CNS淋巴瘤(其中15例SCNSL)患者进行了伊布替尼单药治疗的探索。结果显示,在SCNSL患者中,伊布替尼的客观缓解率(ORR)高达69%,这一数据令人鼓舞,表明伊布替尼在SCNSL的治疗中具有显著的疗效[12]。
另外一项研究进一步证实了伊布替尼在SCNSL治疗中的优势。在这一系列SCNSL患者中,与基于高剂量抗代谢物的化疗方案相比,使用伊布替尼具有更高的缓解率和更长的PFS和OS。具体而言,接受伊布替尼治疗的患者中位OS达到了16.8个月,而接受强化中枢神经系统定向化疗的患者中位OS仅为4.4个月。这一数据对比凸显了伊布替尼在SCNSL治疗中的优势[13]。
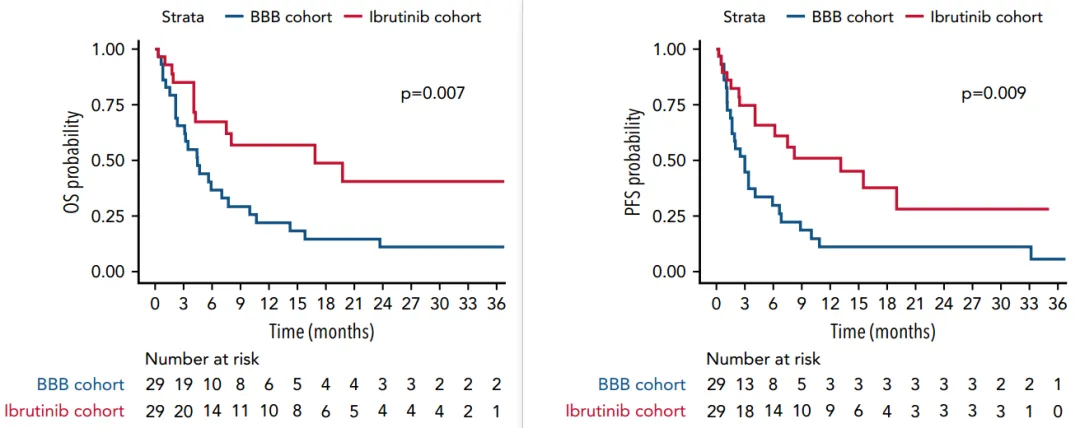
图4 与基于高剂量抗代谢物的化疗方案相比,使用伊布替尼具有更长的OS和PFS[13]
其他BTK抑制剂包括泽布替尼以及中国原研的奥布替尼等都在相关临床研究中展现出更优于伊布替尼的中枢透过率,有望成为SCNSL患者的新选择。一项回顾性研究纳入接受含泽布替尼治疗的13例患者(8例PCNSL,5例系统性DLBCL),其中61.5%为复发/难治,84.6%累及中枢神经系统,总的ORR为84.5%,涉及中枢神经系统病例的ORR为81.8%[14]。另外一项研究比较了奥布替尼与伊布替尼治疗复发/难治PCNSL患者的疗效和安全性,共350名患者被纳入(队列1:利妥昔单抗+奥布替尼,105例;队列2:奥布替尼,107例;队列3:伊布替尼,117例)。结果显示,与队列3相比,队列1的ORR和DCR更高(P<0.0001);队列2的DCR更高(P=0.0062)。队列1的ORR高于队列2(P=0.0188)[15]。
● 抗体-药物偶联物(ADC):维泊妥珠单抗(Pola)
维泊妥珠单抗是首个获批的抗B细胞特异性表面蛋白CD79b的抗体偶联药物,由抗CD79b抗体和抗有丝分裂剂甲基澳瑞他汀E偶联而成[16]。
一项双盲、安慰剂对照的国际Ⅲ期临床试验评价了改良的Pola-R-CHP方案(用Pola替代长春新碱)与标准R-CHOP方案治疗初诊DLBCL患者的效果。该研究将879例患者随机分组,中位随访28.2个月,结果显示Pola-R-CHP组(n=440)2年无进展生存百分比显著高于R-CHOP组(n=439):76.7% vs 70.2%;两组2年OS比较差异无统计学意义[17]。
● 双特异性抗体:格菲妥单抗
作为一种创新的CD3×CD20双特异性抗体,在DLBCL的治疗领域已展现出了显著的潜力和优势。
最近一项研究首次报道了格菲妥单抗用于治疗SCNSL的病例数据,并深入探讨了其通过血脑屏障及诱导患者临床反应的能力。在这项研究中,研究人员发现格菲妥单抗能够部分渗透血脑屏障,进入中枢神经系统并发挥治疗作用。这一发现为SCNSL的治疗提供了新的可能性。此外,研究还显示格菲妥单抗能够安全地诱导SCNSL患者的临床和影像学反应。这意味着在接受格菲妥单抗治疗后,患者的症状得到了缓解,同时影像学检查也显示出了肿瘤体积的缩小或消失[18]。
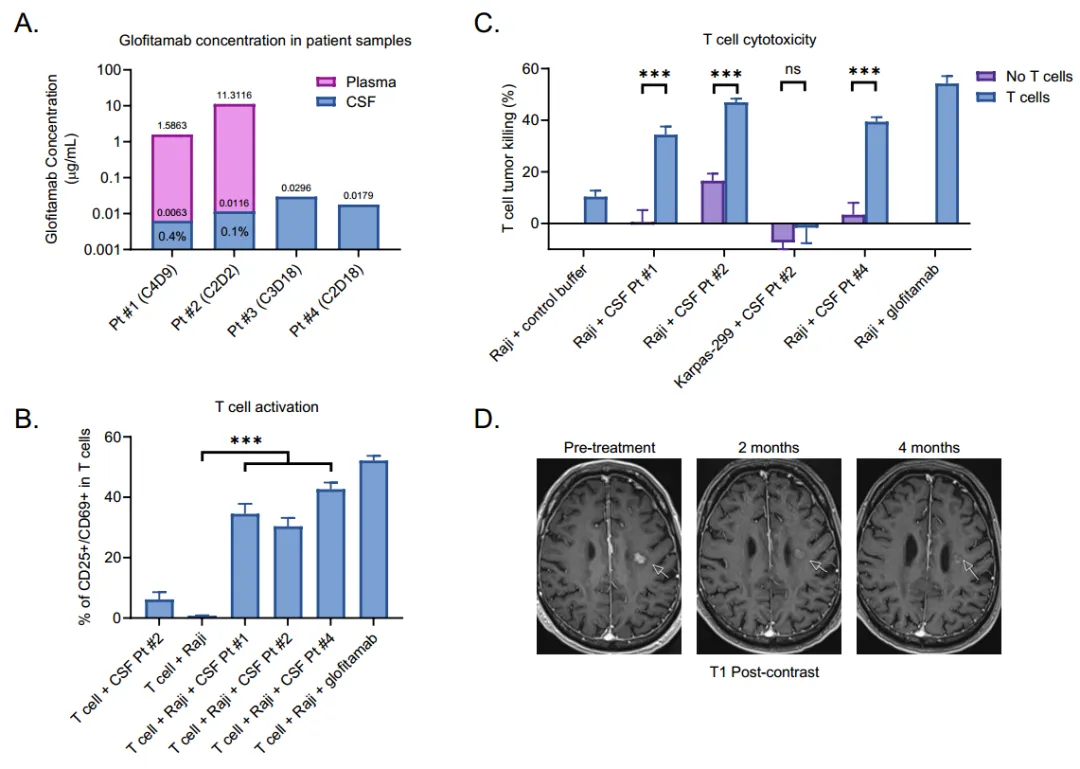
图5 格菲妥单抗在脑脊液中达到足够的浓度,可以在体外驱动T细胞活化和对CD20+淋巴瘤细胞的细胞毒性(A-C);格菲妥单抗用于治疗SCNSL的临床疗效(D)[18]
2
临床进展——细胞治疗
Juan Pablo Alderuccio及其团队深入探讨了SCNSL与DLBCL、伯基特淋巴瘤(BL)以及套细胞淋巴瘤(MCL)的治疗策略。其中,在涉及全身性DLBCL并伴随实质中枢神经系统受累的病例中,对于年龄在70岁以下的患者,研究团队特别推荐了MATRix-R-ICE方案,并结合基于塞替派的ASCT作为巩固治疗;对于那些出现孤立性中枢神经系统复发的DLBCL患者,研究结果同样显示MATRix方案(可包含或不含R-ICE)的疗效显著,对于治疗后有积极反应的患者,团队建议采用塞替派-ASCT进行进一步的巩固治疗;对于一线治疗后复发的DLBCL伴中枢神经系统复发的患者,研究团队则强烈推荐了CAR-T细胞治疗[1]。
由此可见,ASCT和CAR-T细胞治疗在淋巴瘤的治疗中展现出了巨大的潜力,为临床医生提供了更多有效的治疗选择,也为患者带来了新的治疗希望。
01
高剂量治疗联合自体造血干细胞移植(HDT-ASCT)
对于SCNSL患者而言,HDT-ASCT可以挽救一部分化疗敏感且适合移植的患者。最近一项关于124例SCNSL的多中心研究表明,在HDT-ASCT后,DLBCL-SCNSL患者的中位PFS和OS均有所改善。HDT-ASCT的重要性不仅体现在其对于诱导治疗无反应患者的良好反应和生存上,更在于其为新发DLBCL-SCNSL患者带来了显著的生存益处。数据显示,这部分患者的长期生存率高达65%[19]。
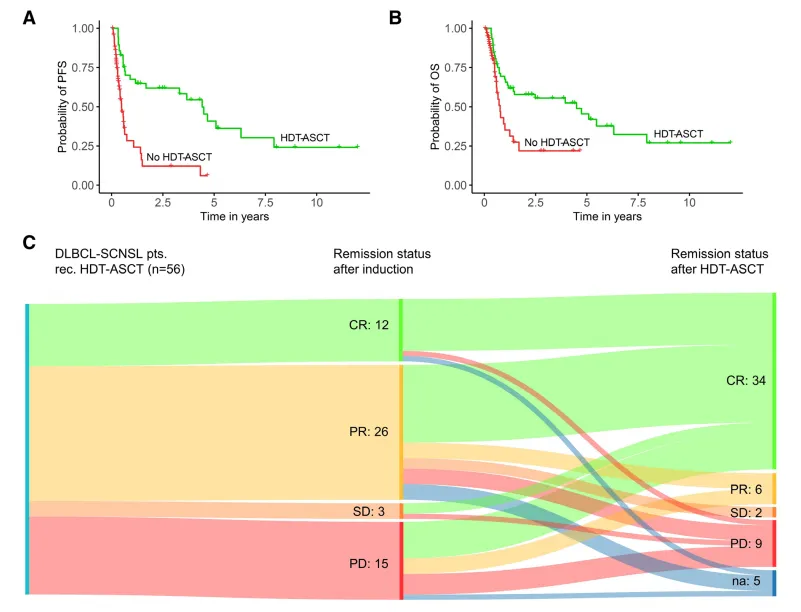
图6 HDT-ASCT在DLBCL-SCNSL中的作用[19]
MARIETTA试验评估了MATRix(甲氨喋呤、阿糖胞苷、塞替派和利妥昔单抗)序贯联合RICE(利妥昔单抗、异环磷酰胺、卡铂和依托泊苷)和卡莫司汀-塞替派治疗DLBCL诊断或复发时继发性中枢神经系统受累的患者自体造血干细胞移植的安全性和活性。共有79例患者入组,其中可评估患者75例。研究团队发现,在入组后1年达到主要终点时,42例患者无进展(无进展生存率58%),49例(65%)在MATRix-RICE后有客观反应,其中29例(39%)有完全反应。37例有反应的患者接受了自体造血干细胞移植。在项目结束时,46名患者(61%)有客观反应,客观反应的中位持续时间为26个月。中位随访29个月,35例患者无进展,33例患者存活,2年总生存率为46%。这一结果充分证明了MATRix-RICE联合自体造血干细胞移植在预后极差的SCNSL患者中的有效性,并且该治疗方案的毒性水平也在可接受范围内[20]。
一项关于继发性中枢神经系统淋巴瘤真实世界治疗和结果的前瞻性观察研究报告了243例SCNSL患者的临床数据和预后,其中队列Ⅰ(n=49,初诊全身性淋巴瘤时伴SCNSL的患者),队列Ⅱ(n=194,既往诊断的全身性淋巴瘤复发时发生SCNSL的患者)。在治疗策略上,大多数患者选择了全身(静脉)治疗的方式(队列Ⅰ,n=27;队列Ⅱ,n=86)或全身和鞘注联合治疗的方案(队列Ⅰ,n=19;队列Ⅱ,n=80)。在队列Ⅰ中,患者最常接受以大剂量甲氨蝶呤(HD-MTX)为基础的治疗方案(n=33),27名患者予以R-CHOP/(R)-MTX方案,21名患者接受了高剂量阿糖胞苷(HD-AraC)为基础的治疗方案。在队列Ⅱ中,160名患者接受了基于HD-MTX的治疗方案,118例患者采用以HD-AraC为基础的化疗方案,在这两个队列中共有103例患者接受了HDT-ASCT。从治疗效果来看,两个队列的初始SCNSL治疗(诱导治疗)的总缓解率为54%,其中完全缓解(CR)35%,部分缓解(PR)19%。在生存期方面,诊断为SCNSL后的中位OS为17.2个月,队列Ⅰ的中位OS(60.6个月)比队列Ⅱ(11.4个月)更长。此外,接受HDT-ASCT与部分缓解或更好与更长的OS相关(HR=0.47,95% CI:0.25~0.89,P=0.0197)[21]。
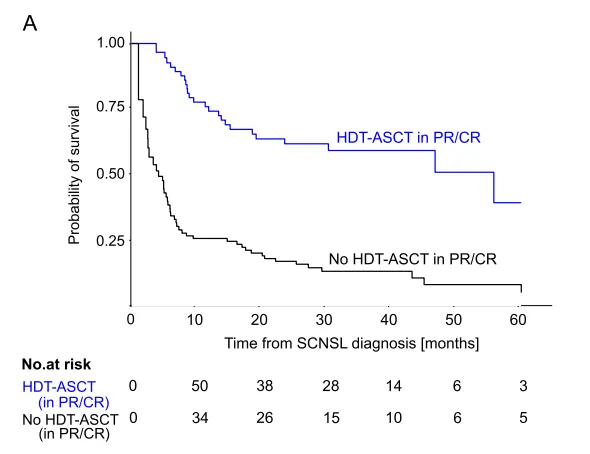
图7 接受和不接受HDT-ASCT的SCNSL患者生存率[21]
02
CAR-T细胞治疗
对于复发和难治的淋巴瘤患者,传统的挽救治疗联合自体造血干细胞移植是主要的策略,但这一治疗路径并非都适用于所有患者。据统计,仅有约25%的患者符合自体造血干细胞移植的条件,且仅有约10%的患者能从中获得长期的疾病缓解。对于那些因各种原因不适合接受自体造血干细胞移植或移植后病情复发的患者,他们的预后和生存状况往往堪忧。而CAR-T细胞治疗为这类患者提供了新的治疗希望。CAR-T细胞治疗是一种经过基因改造的细胞治疗,为这些患者提供了一种新的可能实现持久缓解甚至治愈的治疗选择,具有广阔的应用前景[22]。
在2023年11月9日公布的一项多中心回顾性研究中,研究团队评估了接受CAR-T治疗的SCNSL患者的预后。共有61例患者被纳入分析,总有效率为68%,CR率为57%。在多变量分析中,发生任何级别CRS的患者实现CR的几率更高(OR=3.9,95% CI:1.01~15.39,P=0.047)。中位PFS为3.3个月,6个月和12个月的PFS率分别为35%和16%。中位生存期为7.6个月,6个月和12个月的生存期分别为59%和41%,该研究为未来探索SCNSL新治疗方案的试验提供了方向[23]。
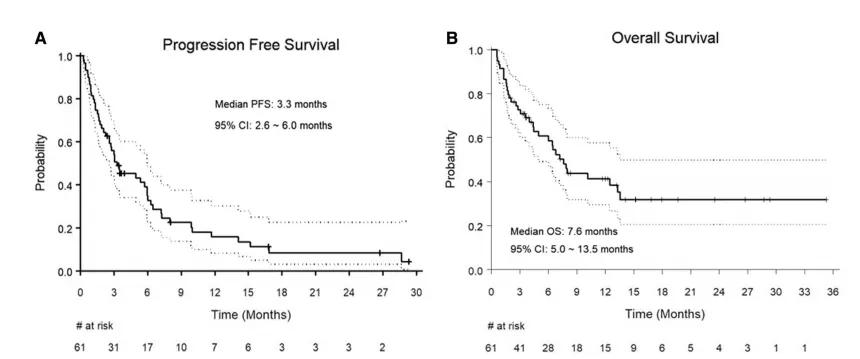
图8 CAR-T治疗SCNSL患者的生存分析[23]
此外,另一项关于CAR-T治疗原发性和继发性中枢神经系统淋巴瘤的研究也取得了良好的结果。这项研究共纳入了17例原发性中枢神经系统淋巴瘤患者(PCNSL)和27例SCNSL患者。经过CAR-T治疗后,有31例(68.9%)出现中枢神经系统缓解,其中18例(40.0%)中枢神经系统疾病完全缓解,中位持续时间为11.4个月±4.5个月。该研究表明了CAR-T细胞治疗在中枢神经系统淋巴瘤治疗中的疗效和安全性。CAR-T细胞治疗为这些患者提供了新的治疗选择,随着技术的不断进步和临床研究的深入,相信这一技术将在未来为更多患者带来福音[24]。
03
去化疗趋势下,传统化疗在中枢神经系统淋巴瘤中的作用
对于SCNSL,鞘内注射(IT)和以大剂量甲氨蝶呤(HD-MTX)为主的联合化疗是应用最为广泛的CNS侵犯预防方式和治疗方式。
(1)IT
IT甲氨蝶呤(MTX)和/或阿糖胞苷的CNS病变的防治,通常联合类固醇,历来用于侵袭性B细胞淋巴瘤的治疗。然而,随着医学研究的深入,特别是在针对DLBCL(弥漫性大B细胞淋巴瘤)患者的治疗实践中,我们发现传统的IT预防策略面临了一些挑战。
当前,DLBCL患者的中枢神经系统侵犯主要表现为脑实质的受累,而药物在通过蛛网膜下腔时,其穿透血脑屏障的能力相对较弱。大多数回顾性研究和前瞻性试验的分析显示,IT预防效果并不显著。最近的回顾性系列研究表明,无论是老年患者还是高风险的DLBCL患者,都没有显示出IT预防带来的明显益处。
但是,根据国际结外淋巴瘤研究组(IELSG)进行的两项前瞻性单臂研究的数据,在睾丸DLBCL患者中,IT预防可能在预防中枢神经系统病变中发挥作用。IELSG10研究(n=53)显示,与之前的回顾性研究相比,接受R-CHOP+对侧睾丸照射和4次IT MTX治疗的患者(5年累积风险为6%)的CNS复发风险较低。此外,在中位随访5年后,IELSG30试验分析了54例接受R-CHOP、对侧放疗和2个疗程治疗末的HD-MTX(1.5 g/m2)加4次IT阿糖胞苷加强CNS预防的患者,均没有出现中枢神经系统复发。因此许多中心已将IT MTX和治疗结束时的HD-MTX作为这类特殊淋巴瘤患者的中枢神经系统预防策略[25]。
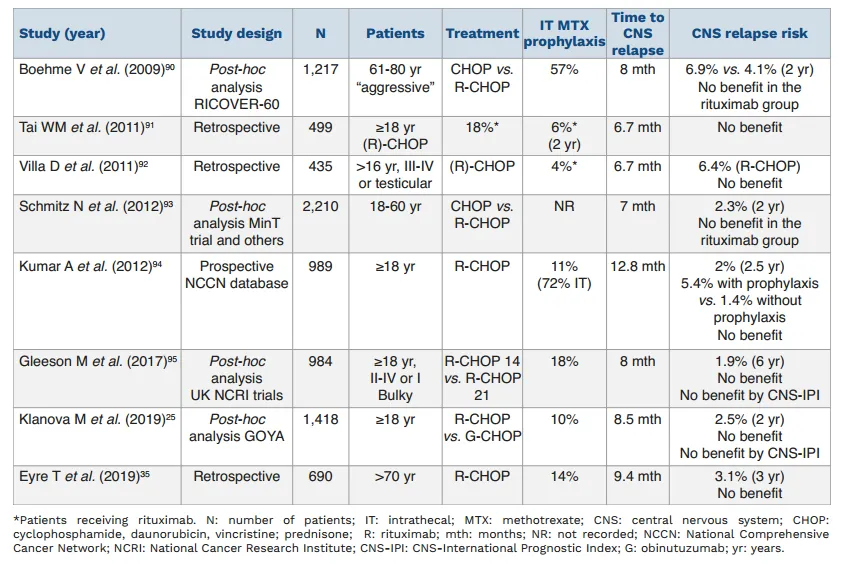
图9 评估鞘内注射预防SCNSL的相关研究[25]
(2)HD-MTX
近年来,HD-MTX(≥3 g/m2)被认为是高危DLBCL患者CNS-L的潜在预防策略。最初的回顾性研究表明,HD-MTX在预防中枢神经系统淋巴瘤方面具有潜在的益处。然而,近年来,几项大型回顾性研究未能证明其能减少中枢复发。最近的一项多中心研究纳入了906例患者,其中326例为高危患者,结果显示,接受HD-MTX的患者中枢神经系统复发风险为12.2%,而未进行预防的患者为11.2%[25]。
关于HD-MTX的最佳剂量或时间尚未达成共识。Wilson等人进行了一项多中心回顾性研究,对1384名接受R-CHOP样方案和HD-MTX预防治疗的患者进行了研究,无论是在治疗期间还是在治疗结束时,他们得出结论,接受这两种策略治疗的患者在中枢神经系统复发风险方面没有差异。此外,在19.3%的患者中,插入HD-MTX与毒性增加相关,导致后续R-CHOP的推迟。这些结果表明,如果要使用HD-MTX,应在R-CHOP治疗结束时给予[25]。

图10 评估使用HD-MTX预防SCNSL的相关研究[25]
虽然HD-MTX越来越多地用于DLBCL的中枢累及的治疗,但HD-MTX因为不良反应较大而应用受限,例如急性肾损伤、黏膜炎等,因此对绝大多数患者现更倾向于在治疗结束后给药或者优先考虑全身治疗,甚至在部分患者中完全放弃使用HD-MTX[25]。
04
全身化疗后单纯中枢复发,全身化疗是否需要继续应用?
SCNSL在临床上有三种不同的情况:(1)新发时伴有中枢神经系统和全身性淋巴瘤(TN-SCNSL);(2)中枢神经系统复发无系统性淋巴瘤复发(孤立中枢神经系统淋巴瘤复发,RI-SCNSL);(3)系统性淋巴瘤治疗后复发的全身和中枢神经系统疾病(RC-SCNSL)[25, 26]。面对这些不同的情况,治疗方案的选择显得至关重要。
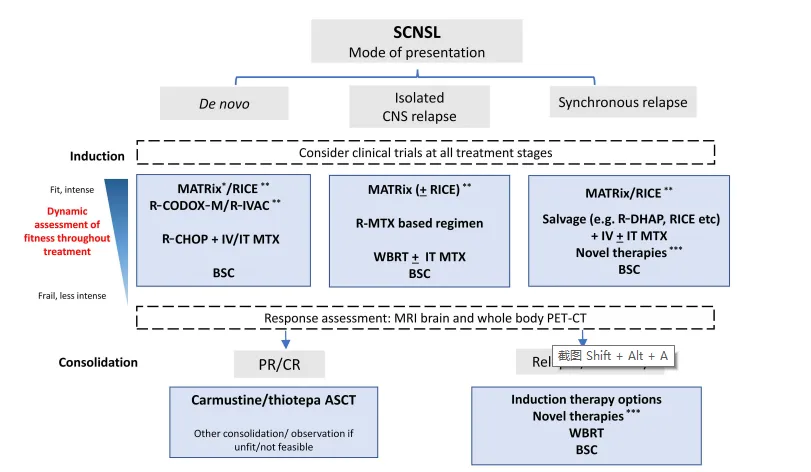
图11 SCNSL的治疗方法[25]
对于新发症状的患者,适合患者的首选方案包括MARIETTA方案(在实现部分或完全缓解或ASCT前疾病稳定的患者中,采用MATRix/RICE诱导和基于塞替派的条件ASCT巩固)或RCODOX-M/IVAC。适应度较低的患者可以通过合理的R-MTX-Ara-C/RICE、R-CHOP和静脉或鞘内MTX治疗获得应答,同时考虑使用ASCT巩固和塞替派治疗[26]。
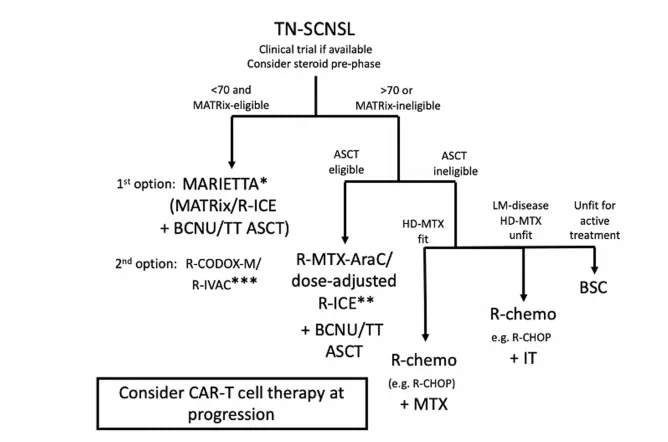
图12 TN-SCNSL的治疗[26]
在孤立复发的患者中,治疗方案的选择同样需要根据患者的具体情况来决定。对于适合的患者,首选含卡莫司汀/塞替派的预处理+ASCT巩固,或MARIETTA方案。适应度较差的患者可以通过基于R-MTX-Ara-C的方案获得应答,并且可以考虑ASCT巩固[26]。
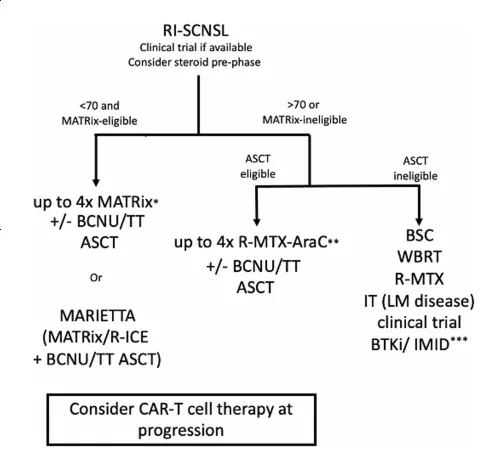
图13 RI-SCNSL的治疗[26]
对于出现同步复发的患者,适合患者的首选方案包括MATRix/RICE和ASCT巩固(MARIETTA方案)。不适合的患者可以通过挽救性化疗(RICE,R-DHAP等)或基于当时的新方案,在诱导时添加静脉注射或鞘内MTX,然后进行ASCT巩固(在ASCT前实现部分/完全缓解的患者)[26]。
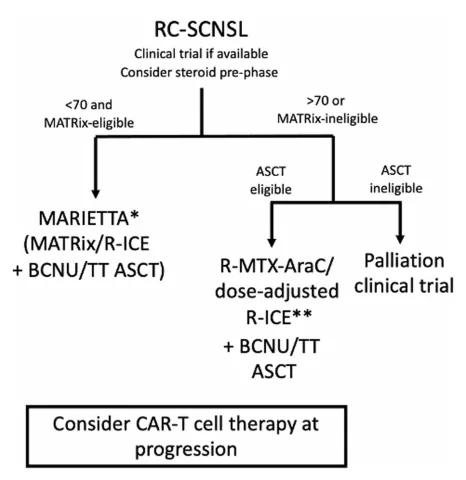
图14 RC-SCNSL的治疗[26]
在某些情况下,对于完成化疗、ASCT巩固后仍有残留疾病证据的RI-SCNSL患者,或干细胞动员失败不进行ASCT的患者,全脑放疗(WBRT)可能是一个值得考虑的选择。WBRT可将患者转化为CR,WBRT后CR的患者的中位生存期为24个月,约30%的患者获得持久缓解。此外,全身治疗失败后孤立性中枢神经系统进展的年轻患者也可以考虑WBRT[26]。
淋巴瘤对药物治疗敏感,在细胞毒性药物治疗的基础上,近年来随着小分子靶向药物(例如PI3K抑制剂、BTK抑制剂、核输出蛋白抑制剂、BCL2抑制剂等)、新靶点单抗药物(如CCR4单抗)、抗体偶联药物(如CD79b、CD30抗体偶联MMAE)、双特异性抗体(如CD3-CD20双抗)和细胞治疗(CAR-T和CAR-NK)的进展,淋巴瘤患者的预后持续改善。尽管我们已经取得了一定的治疗进展,但是在SCNSL这一领域仍存在许多未满足的需求。因此,临床亟需深入探索现有方案在中枢神经系统淋巴瘤中的应用,为患者提供更为全面和有效的治疗选择。


参考文献
[1]Alderuccio JP, Nayak L, Cwynarski K. How I treat secondary CNS involvement by aggressive lymphomas[J]. Blood, 2023, 142(21): 1771-1783.
[2]Bromberg JEC, Issa S, Bakunina K, et al. Rituximab in patients with primary CNS lymphoma (HOVON 105/ALLG NHL 24): a randomised, open-label, phase 3 intergroup study[J]. Lancet Oncol, 2019, 20(2): 216-228.
[3]Ferreri AJM, Calimeri T, Conte GM, et al. R-CHOP preceded by blood-brain barrier permeabilization with engineered tumor necrosis factor-α in primary CNS lymphoma[J]. Blood, 2019, 134(3): 252-262.
[4]中国抗癌协会淋巴瘤专业委员会. 来那度胺治疗淋巴瘤中国专家共识(2024年版)[J]. 中国肿瘤临床, 2024, 51(1): 1-8.
[5]Ayed AO, Chiappella A, Pederson L, et al. CNS relapse in patients with DLBCL treated with lenalidomide plus R-CHOP (R2CHOP): analysis from two phase 2 studies[J]. Blood Cancer J, 2018, 8(7): 63.
[6]Rubenstein JL, Geng H, Fraser EJ, et al. Phase 1 investigation of lenalidomide/rituximab plus outcomes of lenalidomide maintenance in relapsed CNS lymphoma[J]. Blood Adv. 2018, 2(13): 1595-1607.
[7]EngelhardtM, AjayiS, ReinhardtH, et al. Pomalidomide[J]. Recent Results Cancer Res, 2018, 212: 169-185.
[8]TunHW, JohnstonPB, DeAngelisLM, et al. Phase 1 study of pomalidomide and dexamethasone for relapsed/refractory primary CNS or vitreoretinal lymphoma[J]. Blood, 2018, 132(21): 2240-2248.
[9]NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®): Central Nervous System Cancers(2023).
[10]庞迪文, 陈菲莉, 李文瑜. 伊布替尼在原发性中枢神经系统淋巴瘤中的应用[J]. 中华血液学杂志, 2020, 41(04): 348-350.
[11]Younes A, Sehn LH, Johnson P, et al. Randomized Phase III Trial of Ibrutinib and Rituximab Plus Cyclophosphamide, Doxorubicin, Vincristine, and Prednisone in Non-Germinal Center B-Cell Diffuse Large B-Cell Lymphoma[J]. J Clin Oncol, 2019, 37(15): 1285-1295.
[12]Grommes C, Wolfe J, Gavrilovic I, et al. Phase II of single-agent Ibrutinib in recurrent/refractory primary (PCNSL) and secondary CNS lymphoma (SCNSL)[J]. Blood, 2018, 132(Suppl 1): 2965.
[13]Rusconi C, Cheah CY, Eyre TA, et al. Ibrutinib improves survival compared with chemotherapy in mantle cell lymphoma with central nervous system relapse[J]. Blood, 2022, 140(17): 1907-1916.
[14]Zhang Y, Li Y, Zhuang Z, et al. Preliminary Evaluation of Zanubrutinib-Containing Regimens in DLBCL and the Cerebrospinal Fluid Distribution of Zanubrutinib: A 13-Case Series[J]. Front Oncol, 2021, 11: 760405.
[15]Qiao L, Liu Q, Huang C. Orelabrutinib versus ibrutinib for patients with refractory/relapsed primary central nervous system lymphoma: An efficacy and safety analysis[J]. Medicine (Baltimore), 2023, 102(27): e33880.
[16]王娅, 余田田, 余莉. 弥漫大B细胞淋巴瘤的新型免疫药物治疗进展[J]. 南昌大学学报(医学版), 2024, 64(02): 75-80+106.
[17]Tilly H, Morschhauser F, Sehn LH, et al. Polatuzumab Vedotin in Previously Untreated Diffuse Large B-Cell Lymphoma[J]. N Engl J Med, 2022, 386(4): 351-363.
[18]Godfrey JK, Gao L, Shouse G, et al. Glofitamab stimulates immune cell infiltration of CNS tumors and induces clinical responses in secondary CNS lymphoma[J]. Blood, 2024, 2024024168.
[19]Treiber H, Nilius-Eliliwi V, Seifert N, et al. Treatment Strategies and Prognostic Factors in Secondary Central Nervous System Lymphoma: A Multicenter Study of 124 Patients[J]. Hemasphere, 2023, 7(8): e926.
[20]Ferreri AJM, Doorduijn JK, Re A, et al. MATRix-RICE therapy and autologous haematopoietic stem-cell transplantation in diffuse large B-cell lymphoma with secondary CNS involvement (MARIETTA): an international, single-arm, phase 2 trial[J]. Lancet Haematol, 2021, 8(2): e110-e121.
[21]Habringer S, Demel UM, Fietz AK, et al. A prospective observational study of real-world treatment and outcome in secondary CNS lymphoma[J]. Eur J Cancer. 2024, 196: 113436.
[22]SEHN L H, SALLES G. Diffuse large B-cell lymphoma [J]. N Engl J Med, 2021, 384(9): 842-858.
[23]Epperla N, Feng L, Shah NN, et al. Outcomes of patients with secondary central nervous system lymphoma following CAR T-cell therapy: a multicenter cohort study[J]. J Hematol Oncol, 2023, 16(1): 111.
[24]Karschnia P, Arrillaga-Romany IC, Eichler A, et al. Neurotoxicity and management of primary and secondary central nervous system lymphoma after adoptive immunotherapy with CD19-directed chimeric antigen receptor T-cells[J]. Neuro Oncol, 2023, 25(12): 2239-2249.
[25]Prevention and management of secondary central nervous system lymphoma[J]. Haematologica, 2023, 108(3): 673-689.
[26]Cwynarski K, Cummin T, Osborne W, et al. Management of secondary central nervous system lymphoma[J]. Br J Haematol, 2023, 200(2): 160-169.




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国