“栖息地破碎化”是导致全球生物多样性丧失的重要原因之一。当一个连续的栖息地被分割成多个孤立的小片段时,物种的种群数量就会减少,遗传多样性也会降低,从而增加了物种灭绝的风险。在澳大利亚,虽然拥有独特的生物多样性,却也面临着严重的生态环境问题。
近日,“海洋与湿地”(OceanWetlands)小编在查阅有关“遗传连通性”的学术文献时,注意到一篇2021年发表在《遗传学》(Heredity)期刊上的一项研究。该研究由澳大利亚莫纳什大学生物科学学院的研究人员领导,揭示了澳大利亚一种濒危菊科植物——纽扣皱菊(Rutidosis leptorrhynchoides)的生存困境。研究团队通过对该物种多个种群的基因组进行分析,深入探究了它们的进化历史和遗传连通性。

上图:澳大利亚国立植物园内人工栽培的纽扣皱菊。摄影:Allthingsnative)(CC BY-SA 4.0)
纽扣皱菊(拉丁学名:Rutidosis leptorrhynchoides,英文名:button wrinklewort),也称为纽扣波纹草,曾经是澳大利亚东南部草原生态系统中的常见物种,但由于栖息地丧失和过度放牧等人类活动的干扰,其分布范围急剧缩小,现仅零星分布于维多利亚州和澳大利亚首都特区及新南威尔士州(ACT/NSW)两个相距遥远的地区。研究人员发现,这两个地区的纽扣皱菊种群之间存在显著的遗传分化,表明它们已经独立进化了相当长的时间。
更令人担忧的是,即使在同一个地区内,不同种群之间的基因交流也十分有限。研究人员推测,这可能是由于栖息地破碎化导致种群长期隔离,进而导致遗传多样性降低和近亲繁殖加剧。然而,令人意外的是,维多利亚州的两个纽扣皱菊种群,尽管种群规模较小,但遗传多样性却相对较高。这表明,这些种群可能保留了该物种的古老遗传特征。这项研究结果为纽扣皱菊的保护提供了重要的科学依据。
澳大利亚“纽扣皱菊”
遗传多样性与进化历史概览
全球生物多样性正以空前的速度下降,数以万计的物种面临灭绝的威胁。遗传多样性作为生物多样性的重要组成部分,支持种群的存续,促进适应性和进化能力。因此,维护遗传多样性及其进化过程,如基因流动和适应性变化,对于生物多样性的保护至关重要。在栖息地碎片化的情况下,基因流动的减少会降低新遗传变异的传播,从而降低适应潜力。小种群中的遗传漂变会导致遗传多样性的丧失和自然选择效率的降低,从而导致近亲繁殖衰退和适应潜力下降,进而提高灭绝风险。因此,保护管理必须考虑遗传多样性和基因流动的保护与增强。
为了制定适当的物种遗传管理策略,理解支撑物种分布和种群结构的进化过程至关重要。长期的分歧和短期的漂变,都可能导致种群遗传结构。如果种群在管理时基于错误的假设(如基因独特性而非由于遗传漂变造成的近期分化)进行分开管理,则可能通过孤立和进一步的漂变、加剧遗传多样性的丧失,从而提高灭绝风险。相反,过于不同的种群混合可能会导致近交衰退,尽管这种现象较少见,其发生通常可以通过关注固定的染色体差异、对不同环境的适应以及自上次基因流动以来的时间长度等风险因素来避免。合理实施的遗传救助已经被广泛接受为一种生物多样性保护方法,特别是当恰当评估了混合与不混合基因库的相对风险和利益时。因此,识别导致分化的主要过程对风险评估框架和决策支持工具的制定具有重要意义,以最大限度地提高种群的存续。尽管这些工具日益可用,所需数据也变得更易获取,但基于证据的保护决策仍有很大潜力未被挖掘,而这需要重视维持进化过程的重要性。
重新连接破碎的种群需要了解历史连通性的水平,而这可以通过种群遗传数据进行评估。对遗传结构及过去和现在基因流动的研究已被用于鼓励濒危种群间的杂交,定义恢复本土草原的种子转移区域,并识别遗传材料的来源,以最大化进化潜力并提高恢复成功率。尽管种群遗传学在有效管理方面具有指导潜力,但许多物种的过去和现在的连通性理解仍然缺失。即便相关数据存在,关于种群遗传数据的管理相关解释能够以对管理者有用的方式表达的情况仍然稀少。
纽扣皱菊是一种多年生植物,属于菊科,原产于澳大利亚,曾广泛分布于东南澳大利亚的草地生态系统中。自19世纪早期欧洲人类殖民其栖息地以来,该物种的种群数量、规模都遭受了严重减少,目前根据澳大利亚的《国家环境保护与生物多样性保护法》(1999年)被列为了“濒危物种”。已知其原始分布范围覆盖三个主要区域,每个区域之间相距约500公里:位于澳大利亚首都领地和新南威尔士州的堪培拉地区、维多利亚州墨尔本以西的地区,以及维多利亚州东部的吉普斯兰平原,目前已灭绝。
目前,主要在免受农业和城市化影响的栖息地中,保存着高度破碎的种群。现存的纽扣皱菊分布范围包括约31个小的分离自然种群,其中近一半的种群个体数少于200,且没有一个种群有超过100,000个体。为遏制该物种的种群下降,澳大利亚已采取包括栖息地恢复、监测和补植在内的管理措施。
以九个等位酶位点和十个微卫星位点的先前研究显示,尽管该物种的分布存在较大的中断,但所采集种群之间的分化仅为FST=0.17(等位酶)和0.03-0.14(微卫星),这表明近来仍存在较高的基因流动。中性标记中缺乏与地理大断裂相匹配的重大遗传断裂并非植物分类群中独特的现象,在东南澳大利亚类似分布的植物中也有类似观察。然而,缺乏强烈的种群遗传细分可能反映的是历史而非当代的遗传连通性,因此需要更高分辨率的种群遗传数据以评估基因流动。针对纽扣皱菊的遗传管理,已被提议作为其物种恢复计划的一部分。当前的建议是优先保护大且遗传多样性丰富的种群,因为这些种群很可能是来自相似环境的较小、遗传多样性较低种群的最佳遗传救助来源,这一结论得到了包括野外在内的广泛交叉实验的支持。为进行有针对性的管理,需要深入了解哪些种群最具遗传多样性、以及哪些种群最脆弱。此外,理解遗传变异的分布及其进化过程(如过去的分化和基因流动)对于界定优先保护的种群至关重要。
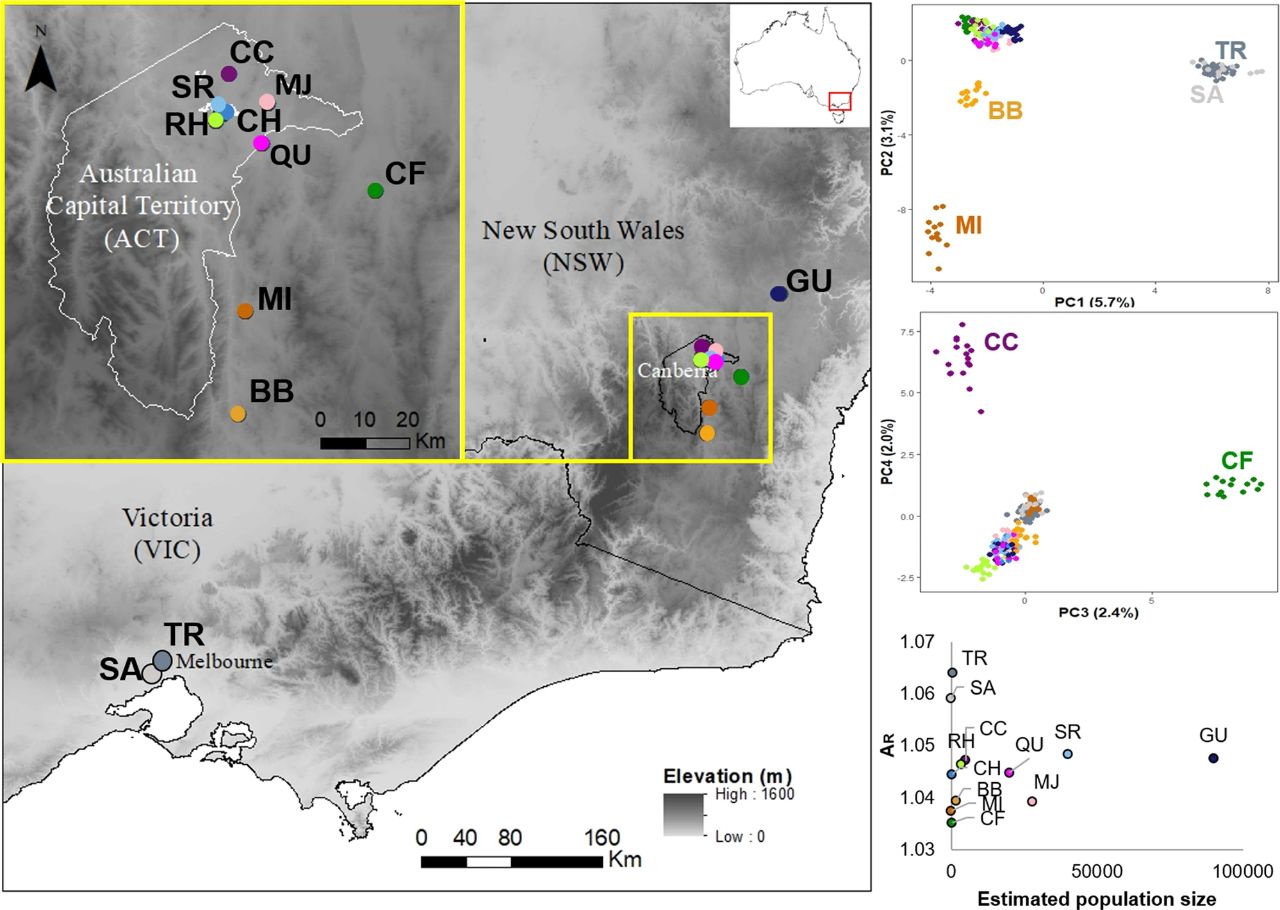
通过分析12,965个单核苷酸多态性(SNP)位点,研究人员对所有12个采样种群进行了主坐标分析(PCoA)。每个种群都对应于表1中的特定代码。图源:Rodger, Y.S., Pavlova, A., Sinclair, S. et al.
本研究利用12,965个单核苷酸多态性位点的数据集,探讨纽扣皱菊的进化历史,并描述其分布区域内种群的全基因组多样性和结构模式。研究的目标包括:量化采样位置之间的全基因组分化水平,并探索驱动这种分化的基础过程;评估各采样位置的全基因组遗传多样性,并测试其是否与之前发布的等位酶和微卫星估计结果一致;推断一些种群遗传历史的关键参数:种群树的拓扑结构、分化时间以及有效种群规模(以突变率进行标定),并通过基于SNP等位基因频率的最大似然种群树探索基因流动在种群隔离或杂交中的作用;并利用这些结果为保护管理规划定义种群。本研究所采用的分子方法,在许多管理场景中都是可行的,能够外包,不需要现有的基因组资源,因此适用于多个物种。
研究方法
纽扣皱菊的遗传多样性研究
纽扣皱菊是一种多年生草本植物,特有于澳大利亚东南部,主要生长在以袋鼠草为主的草地桉树林和无树草原中。该物种在自然环境中的寿命超过10年,主要依靠飞行距离较短的昆虫授粉,如Lasioglossum蜜蜂。种子微弱地依靠风力传播,大多数种子会在距离母株不超过50厘米的范围内落地,并且在土壤种子库中的存留时间较短。缺乏规律的长距离传播,导致纽扣皱菊展现出明显的细粒度空间遗传结构。此外,该物种具有单位位点的孢子体自交不亲和性系统,当花粉与接受植物的S位点等位基因匹配时,花粉会被柱头识别为不相容并被拒绝。S等位基因多样性的减少对种群适应性有害。纽扣皱菊在其分布区域内的染色体数量存在变异,北部和最东南的南部种群为二倍体,而大部分南部种群为自四倍体。研究主要集中于二倍体种群,目前在维多利亚州仅知两处自然种群存在,而在南方约500公里的澳大利亚首都领地和新南威尔士州分别有11个和10个种群。
在采样、基因分型与SNP数据过滤方面:在2017~2018年间,研究人员从12个地点(10个位于澳大利亚首都领地和新南威尔士州,2个位于维多利亚州)收集了199个个体的叶片样本。为确保每个种群的代表性,尽可能采用标准化布局进行采样,具体布局为一个20×15米的矩形区域,包含20个样本点,三行分布,间隔5米。从每个采样点附近的植物中采集基因材料,尽量避免采集年龄小于1年的新株。由于某些采样地点的植物数量过少,研究人员从整个种群中尽量靠近5米网格安排进行采样。在两个种群中,样本个体数量非常小,因此研究人员对当天能找到的每个植物进行采集。对于一个广泛分散的种群,为了保持与其他样本的一致性,研究人员从最大的集群中采集了所有植物。针对某个重点管理地点,在标准布局的基础上,额外采集了边缘植物的样本。
采集的叶样本经过干燥处理后,送至Diversity Arrays Technology Pty Ltd进行DNA提取和基因分型,使用DArTseq™平台。DArTseq™与双消化限制酶相关测序相似,其工作流程经过优化以降低缺失数据的比率。最终的原始基因组数据集包含53,758个共显性双等位基因SNP。在R语言环境中使用DARTR包进行了数据过滤。
在分析遗传结构方面,研究团队使用了STRUCTURE软件估计遗传群体的数量、及各个体在遗传群体中的隶属关系。为了避免缺失数据的影响,使用无缺失数据的1889个SNP数据集进行STRUCTURE分析。每个K值的独立重复运行了10次,结果表明种群在地理区域上存在显著差异。
从种群历史与连通性来说,为探讨种群分化历史,采用了SNAPP使用贝叶斯MCMC方法推断种群树,并在BEAST中运行。SNAPP模型独立为每个SNP位点构建共祖树,并整合所有可能的谱系,以提供树的拓扑结构以及种群分化时间和有效种群规模的参数估计。通过使用TRACER软件对结果进行可视化检查,确认所有参数的有效样本量均大于200。最后,使用了TreeMix分析历史或当代迁移是否能解释种群间的基因流动。

上图:这种植物是一种本土的温季多年生草本植物,高15~30厘米,茎为单茎或少量分枝,从木质根茎丛生而出。叶片大多为茎生,呈线状,长1.5~3.5厘米,宽0.5~1.5毫米。花茎为单头,花序宽半球形,直径8~15毫米。总苞片为5~8层,暗绿色,边缘有时微锯齿或略撕裂,且无细毛。花朵数量众多,均为两性,呈黄色。该植物生长在草地和林地中,在澳大利亚首都地区(A.C.T.)和莫纳罗地区(Monaro)较为稀少。摄影:哈利·罗斯(Harry Rose)
研究结论+讨论
基因分化与多样性
该研究揭示了纽扣皱菊在维多利亚州(VIC)与新南威尔士州和澳大利亚首都特区(ACT/NSW)之间的显著基因分化。通过多种分析手段,研究发现,主成分分析(PCoA)的第一主成分(PC1)解释了6.17%的总变异,清晰地区分了维多利亚州与ACT/NSW的样本位置。进一步的分析表明,PC2、PC3和PC4分别解释了3.05%、2.4%和1.9%的变异,尤其是新南威尔士州的BB和MI样本在PC2中表现出明显的分化。尽管维多利亚州的两个样本位置在前六个主成分轴上未显示出显著的分化,整体结果依然表明这两个区域之间存在遗传差异。
在对12个采样位置进行的STRUCTURE分析中,使用Delta K方法得出的最佳K值为2,显示维多利亚州形成一个集群,而ACT/NSW则形成另一个集群。尽管在K值大于2时,南方(维多利亚州)与北方(ACT/NSW)位置的分离持续存在,但根据ln Pr(X|K)方法的结果,未能确定出最佳K值。单独分析ACT/NSW时,Delta K方法支持存在九个遗传集群,而ln Pr(X|K)方法则支持八个。随着K值的增加,大多数采样位置被分配到各自的集群中,仅有SR和CH这两个相距不到1公里的位置被划归为同一集群。
在样本中,AMOVA分析显示,将采样位置按照地理区域进行分组可以解释8.08%的变异,而区域内的采样位置则解释了21.50%的变异。此外,成对FST比较显示大多数采样位置之间存在显著差异,特别是在涉及新南威尔士州的MI和CF以及维多利亚州的SA时。整体而言,未发现所有位置之间的明显隔离效应。
遗传多样性和种群规模估计结果显示,二者之间并不存在相关性。尽管南方位置的TR和SA表现出最高的杂合度,但相对较小的北方种群BB、CF和MI却显示出较低的遗传多样性。尤其值得注意的是,尽管MJ的种群规模超过28000株,其观察到的杂合度仍然偏低。
在样本中,大约62%的等位基因在ACT/NSW和维多利亚州之间是共享的,而19.8%的等位基因仅存在于ACT/NSW中,18.3%则是维多利亚州特有。这些特有等位基因的绝大多数为稀有等位基因,表明尽管在样本中存在遗传分化,但主要还是由于基因漂变造成的孤立现象。
基因组分析结果表明,纽扣皱菊的南北种群在遗传上有明显的分裂,这种分裂在之前的研究中已有所提示。研究人员认为,这种分化反映了该物种当前地理分布的断裂现象。这种分布的间断与南澳大利亚的许多其他物种相似,包括植物、昆虫和爬行动物等,许多物种均面临较高的保护关切。研究指出,气候变化导致的草地栖息地的大规模连接与断裂可能是这种生物地理模式的驱动因素。
孤立种群的遗传漂变在纽扣皱菊的种群结构中起着关键作用,尤其是在南新南威尔士州的CF、BB和MI等位置。虽然纽扣皱菊是一个自交不亲和的物种,遗传漂变对其种群的影响可能会加重。尽管一些维多利亚州的种群在数量上显著下降,但它们依然保持着较高的遗传多样性。当前的研究强调了这些种群在遗传管理方面的潜在价值,并建议采取必要的保护措施。
这项纽扣皱菊的研究揭示了南北种群之间的显著遗传分化以及基因漂变的影响,突显了加强遗传管理和保护的重要性。研究人员指出,维多利亚州的种群由于其小型且逐渐下降的规模,面临灭绝的风险。然而,相对于种群规模,这些种群的遗传多样性依然较高。对于维多利亚州的种群而言,增加这种植物的种群数量,可能比提升遗传多样性更为紧迫。尽管如此,所有的种群仍可能因遗传漂变而失去遗传变异,尤其是SA种群,其个体数量极少,可能会受到繁殖能力的限制。
海湿·小百科
01基因漂变
基因漂变(Genetic Drift)是指在一个种群中,基因频率由于随机事件而发生的变化。这种变化不是由自然选择等适应性压力引起,而是纯粹的偶然事件导致的,尤其在小种群中表现得更加明显。随机性的作用可能会使某些等位基因的频率增加或减少,甚至完全从种群中消失,导致种群内的遗传变异降低。
基因漂变的效果在小规模种群中更为显著,因为每一代的个体数较少,使得随机事件对基因库的影响更大。例如,在一个小种群中,少数个体的繁殖成败可能显著改变后代的基因频率,产生明显的遗传偏差。随着时间推移,基因漂变可能导致不同种群之间的基因库逐渐分化,尽管这些种群可能在相似的环境中生活。
02自交不亲和性
自交不亲和性(Self-incompatibility)是植物的一种机制,阻止同一植株或基因型的花粉成功受精,以促进遗传多样性。自交不亲和性通过识别和排斥自身花粉,确保受精过程只发生在遗传上不同的个体之间。这一机制在许多被子植物中广泛存在,特别是在那些依赖风或昆虫传粉的物种中。
自交不亲和性通常通过特定的基因系统控制,这些基因决定花粉和胚珠表面蛋白质的兼容性。当花粉与雌蕊的自交不亲和基因匹配时,受精过程会被抑制。这一机制有助于防止近亲繁殖,保持种群的基因多样性,并增强植物对环境变化的适应能力。
一个经典的自交不亲和性例子是十字花科植物(比如说,白菜、油菜)。在这些植物中,自交不亲和性是通过一组特定的基因控制的。如,在油菜中,如果花粉来自同一基因型的植株,那么受精就会被阻止。只有来自不同基因型的花粉才能成功受精,从而形成种子。这种机制不仅促进了基因多样性,还提高了作物的产量和适应性,是现代农业中选育和培育高产优质作物的重要考量之一。不过在上面的研究中,纽扣皱菊是“自交不亲和”物种,这对于本来就很濒危的这个物种来说,就可能影响其种群的繁殖能力。
03FST值
FST值是一种测量基因群体间遗传分化程度的指标,它反映了不同群体之间的遗传变异与群体内部遗传变异的比例。具体而言,FST值的计算基于等位基因频率,值范围从0~1,其中0表示群体之间没有遗传分化,所有个体在遗传上完全相同,而1则表示群体间完全分化,个体间没有共享的等位基因。作为衡量种群间的遗传分化程度的一个值,在纽扣皱菊的这个研究中,通过成对比较不同采样地点之间的FST值,研究者发现大多数采样地点之间存在显著的遗传差异。
FST值在生态学和进化生物学中具有重要意义,它可以用来评估物种的遗传结构、迁移模式和种群历史。例如,通过分析FST值,研究者能够了解物种是否因地理隔离或其他环境因素而产生了明显的遗传差异,从而帮助制定保护策略和管理措施以维护生物多样性。
04分子方差分析
分子方差分析(AMOVA)是一种统计方法,用于评估不同组之间的遗传变异。它是基于基因型数据的一种方差分析,能够揭示在种群内和种群之间的遗传差异。AMOVA的主要目的是将总遗传变异分解为若干成分,以便分析这些变异是如何在不同层次(例如个体、种群、或群体)之间分配的。AMOVA常用于生态学和进化生物学研究中,尤其是在种群遗传结构的研究中。通过这种分析,研究者可以了解不同环境因素或地理隔离对种群遗传多样性的影响,为物种保护和管理提供重要的信息。
思考题·举一反三
Q1、在当前全球生物多样性丧失的背景下,纽扣皱菊的遗传多样性研究,能给其他濒危植物物种的保护提供什么样的启示和借鉴?
Q2、考虑到纽扣皱菊的空间遗传结构,如何利用现代基因组技术(如全基因组关联研究)识别出关键的选择性位点,以指导对其基因多样性和种群遗传结构的保护策略?
Q3、如何综合运用遗传多样性、生态位模型与物种迁徙理论,以制定针对纽扣皱菊及其栖息地的长远保护计划,特别是在气候变化加剧的情况下,如何预见其未来的地理分布变化?
Q4、有什么类似于纽扣皱菊的物种的保护、最后成功的案例吗?在我国有吗?
欢迎分享你的想法!(请文末留言)
THE END
海湿本文仅代表资讯,不代表平台观点。供参考。
研究作者 | Rodger, Y.S., Pavlova, A., Sinclair, S. et al.
编译 | 王芊佳
编辑 | Linda
排版 | 绿叶
参考资料





 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国