在我们从宏观世界转到微观探索时,往往会产生一个疑问:我们究竟能看到最小的东西极限是什么?从最早的显微镜发明以来,人类第一次看到了细胞和微生物的世界。然而传统光学显微镜的分辨能力存在一个极限,大概为200纳米。这个限制是因光的波长而决定的,任何比这个尺度更小的细节都难以被传统显微镜分辨。这种限制被称为阿贝衍射极限,由德国物理学家恩斯特·阿贝提出。当光通过一个细小的物体或狭缝时会发生衍射,也就是光线在遇到障碍物的边缘时产生偏折,从而使得光无法完全聚焦到极小的点上。光的波长越长,其衍射效应越明显。可见光波长范围大约在400到700纳米之间,这意味着当观测物体的细节小于光波波长的一半时光波就无法分辨这些细节,光学显微镜也就无法聚焦或解析出清晰的图像。
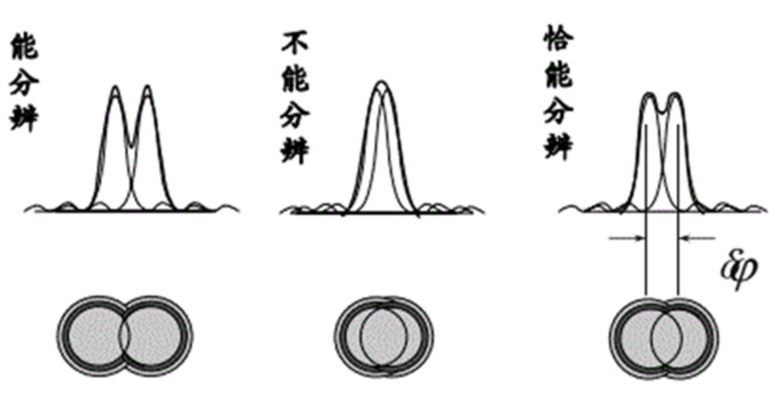
图 衍射极限示意图
由于这一原理,即使采用高质量的镜头和强光源,传统光学显微镜也无法突破这一分辨率极限,对于科学家而言,这意味着许多关键的细胞结构和分子活动无法直接观察,成为科学研究的盲区。在生命科学领域,这一限制尤为明显。许多生物过程发生在亚细胞级别,涉及极其微小的结构和分子。
而且同时,在传统的显微成像中,图像的清晰度也常常因为焦外干扰而受到影响。当显微镜在观察一个样本时,不仅会捕捉到清晰的焦点图像,还会把焦点之外的模糊信息一起记录下来,这会使最终的图像变得不够清晰。有两种较为传统的方法可以提高图像的分辨率和清晰度:光片显微成像和共聚焦显微成像。
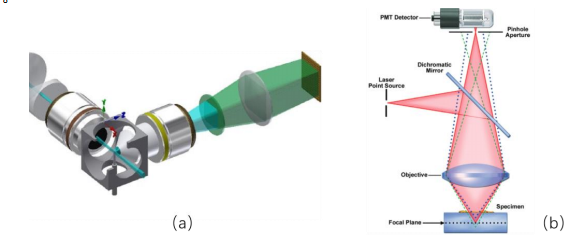
图 (a)光片显微成像;(b)共聚焦显微成像
光片显微成像的工作原理就像是把一层薄光片投射到样本上,只照亮特定的一层。避免把焦点之外的模糊信息记录下来。这就像是用手电筒只照亮书上的某一行文字,而不是整个页面,从而减少不相关的干扰。光片显微成像速度快,对样本的损伤小,非常适合快速捕捉图像,尤其适用于观察活体样本的动态变化。
共聚焦显微成像则采用了选择性透光的方法。通过设立一个小孔,只有焦点上的光可以通过,避免焦外的光线干扰成像。相比于传统的成像方式,共聚焦显微成像能更好地控制清晰度,还可以实现三维成像,适合研究复杂的组织结构。
尽管光片显微成像和共聚焦显微成像都在提高图像的清晰度上有了一定的改善效果,但它们依然受限于显微镜的物理极限,无法分辨比200纳米更小的细节。若要进一步探索微观世界,还需发展更新的技术--超分辨率显微技术应运而生。这项技术可以分为两大类:
第一类技术通过光的精密控制来锐化图像,其中的代表性技术包括受激发射损耗显微镜(STED)和结构光照明显微镜(SIM)。

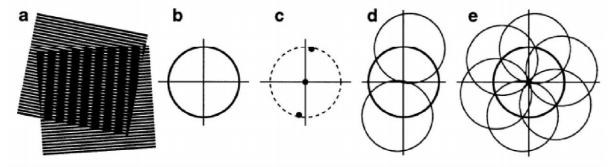
图 受激发射损耗显微镜原理图(左)结构光照明显微镜原理图(右)
受激发射损耗显微镜(STED)的核心在于利用激光精确控制荧光分子的发光区域。它的工作原理是通过两个激光束的配合来控制分子的发光。首先,激发光束将样品中的荧光分子从基态激发到激发态,使它们具备发射荧光的能力。为了突破衍射极限,STED显微镜引入了一束特定形状的抑制光。这束抑制光专门覆盖激发光斑的外围区域,通过受激发射的机制,强制外围区域内的激发态分子返回基态,从而抑制其荧光发射。
这种受控的激光操作确保了只有中心区域的荧光分子能够自发辐射荧光,而外围的荧光被有效关闭。这样,STED显微镜将荧光信号限制在一个更小的空间区域内,从而显著提升了图像分辨率。通过调整抑制光的强度和形状,可以进一步缩小发光区域,理论上能够将分辨率推至分子级别,远超传统光学显微镜的衍射极限。受激发射损耗显微镜的基本理论是,当用激光照射处于激发态的荧光分子时,激发态的荧光分子吸收一个光子后发射两个频率和位相与入射光子相同的光子
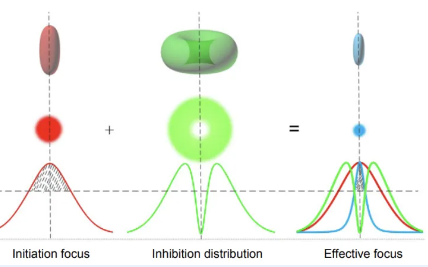
图 STED双光束原理图。可以比作在黑暗中用手电筒照亮一个小区域。普通显微镜的成像类似于普通手电筒,光照区域较大,因此细小的结构难以分辨清楚。受激发射损耗显微镜则通过双重照明来解决这个问题。首先用一束激发光照亮目标区域,使样本中的分子发光,然后再用一束淬灭光环绕激发光的外围。淬灭光就像是一个光学屏障,把外围的发光区域压缩掉,只留下中心极小的部分在发光。这样,成像区域被有效缩小,细节更加集中和清晰,从而实现了更高的分辨率,甚至可以看到小于20纳米的细节。
结构照明显微镜的原理则不同,它基于一种视觉现象——莫尔效应。当两组空间频率接近的周期性光栅图案相互叠加时,会形成一种更低频率的干涉图案。这种条纹是原始高频信息以低频形式呈现的结果,使得肉眼可以观察到原本无法直接分辨的细节。
因为从傅里叶光学的角度来看,图像可以分解为不同空间频率的成分,高频成分代表图像的细节,低频成分则描述整体结构。传统显微镜的分辨率限制来源于其无法捕捉高频成分信息,因为这些成分在光传播中会以倏逝波的形式快速衰减,导致高频信息丢失。
在SIM中,研究人员利用正弦条纹或其他结构光来照明样本。结构光与样本中的细小结构相互作用,生成干涉图案。这些图案将高频信息混叠到较低频率范围,使成像系统能够捕获到这些信息。
接下来,SIM再使用算法从频域中提取出被混叠的高频信息,将其分离并增强。通过计算将这些频谱分量重新定位到它们原本的高频位置。最后,所有信息被拼接到一起,生成一幅超分辨率图像。相比传统显微镜,SIM能够将横向和轴向分辨率提高至两倍左右。
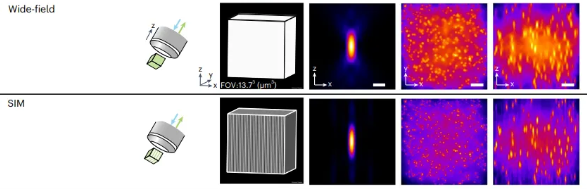
图 SIM技术通过在样本上投射一组细致的光条纹,让条纹与样本中的细小结构发生相互作用形成干涉图案。类似于将不同的条纹图案层层叠加,再通过计算重建得到超分辨率图像。这个过程利用了光学传递函数(OTF)的概念,因为光学系统本质上是一个低通滤波器,导致传统显微镜无法有效传递高频细节信息。而SIM通过调制光的频率和相位,迫使样本中的高频信息“混叠”到OTF的支持区域。最后,通过算法将这些被转移的高频信号从图像中提取出来,重新组合,生成超分辨率图像。这种技术能够提高一倍的横向和轴向分辨率,且不需要对样本进行特殊标记,成像速度快,所以广泛应用于细胞生物学。
第二类超分辨率显微技术的核心是单分子定位成像,这类技术的原理在于逐步定位每一个分子的精确位置,最终拼接出一幅超高分辨率的图像。这类技术最典型的代表包括光激活定位显微术(PALM)和随机光学重建显微术(STORM)。这些技术的出现让我们可以看见远超传统显微镜分辨率极限的细节。
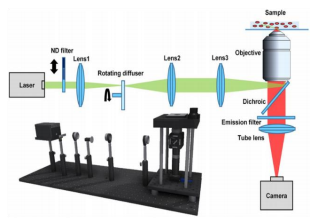
图 STORM装置图
PALM和STORM是如何做到这一点的呢?假如我们正在拍摄一张大合照,如果一次性拍摄所有人就会导致图像模糊,但如果想更清晰地看到每个人的样貌,就可以先聚焦小部分人,拍下这一组,然后再聚焦另一部分人,再拍一张。之后将这些照片叠加起来,这样最终得到的图像便能够清晰呈现每个人的面貌。这正是PALM和STORM技术背后的基本思想。
PALM的全称是光激活定位显微术。这种方法的关键在于逐层成像。就像前文举的例子一样,在PALM显微镜中,样本中的分子不会同时发光,而是分批次地被激活。
STORM(随机光学重建显微术)的工作原理与PALM基本相同,但不同之处在于STORM的分子激发过程是随机的。STORM技术在每一轮成像中会随机激发样本中少数分子发光并记录它们的位置。通过多轮拍摄,将不同位置的分子信号记录下来,在记录了足够数量的定位之后,从测量位置构建高分辨率图像。这时,最终图像的分辨率不受衍射的限制。这使得STORM非常适合观察细胞中的复杂结构,如神经细胞突触中的分子排列或癌细胞中的特定分子分布。
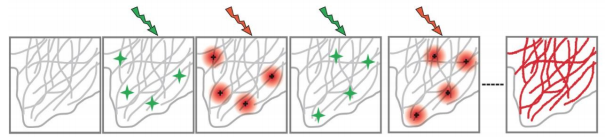
图 随机光学重建显微镜原理示意图
随着人工智能(AI)和机器学习的发展,超分辨率显微技术正逐渐与这些技术相结合,以实现自动化分析。AI和机器学习可以用于处理大量的成像数据,自动识别和分离感兴趣的分子结构,从而极大地提高分析效率。未来,借助AI,能够更快速地从超分辨率图像中提取有用信息,使得数据分析不再依赖人工。
参考文献
[1]肖文.Z轴漂移自校准的随机光学重建显微镜成像系统研究[D].深圳大学,2020.
曹耀宇, 谢飞, 张鹏达, 等. 双光束超分辨激光直写纳米加工技术[J]. 光电工程, 2017, 44(12): 1133-1145.
Temma, K., Oketani, R., Kubo, T. et al. Selective-plane-activation structured illumination microscopy. Nat Methods (2024).







 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国