氨基酸,是一类两性有机化合物,是生物功能大分子蛋白质的基本组成单位1。
氨基酸化学式可写作R-CH (NH2)-COOH,R为侧链基团。大类可分为蛋白质氨基酸和非蛋白质氨基酸。其中蛋白质氨基酸又称标准氨基酸,是直接参与蛋白质分子合成的氨基酸。依据氨基连在碳链上的不同位置,可将氨基酸分为α-,β-,γ-等氨基酸,但生物界中构成天然蛋白质的氨基酸均为α-氨基酸,共22种,包括20种常见氨基酸以及2种不常见氨基酸23。非蛋白质氨基酸则不能直接参与蛋白质分子合成,需经过修饰才能参与蛋白质的合成,如瓜氨酸、鸟氨酸和羟脯氨酸。
氨基酸通常为白色固体粉末,可溶于水。但又因其结构、R基团等不同而具有不同的性质,如等电点、旋光性等。氨基酸的基础物理性质包括熔点、沸点、溶解性等,具体值取决于具体的氨基酸种类。化学性质上,氨基酸具有氨基和羧基,可发生酸碱中和反应,也能参与肽键的形成,在酸碱环境中可能发生解离。氨基酸的检测也可以根据这些性质的不同进行筛选和鉴定。目前发展起来的检测方法有分光光度法、液相色谱、气相色谱、红外检测等多种方法。
氨基酸在生物体内除了构建蛋白质外,还参与体内代谢过程,调节生理功能等。在医药领域,氨基酸被用作药物的原料或辅料;在食品领域,氨基酸被添加到食品中以增强营养价值;在化工领域,氨基酸可用于合成其他化合物。
总的来说,氨基酸作为生命体的基本组成单位,在各个领域都扮演着重要角色。
研究历史
发现
1806年,法国科学家 L.N.Vanquelin和J.P.Robiquet从天门冬(asparagus)的汁液中分离到天冬酰胺 (asparagine,Asn)。1827年,A.Plisson从蜀葵(hollyhock)(Althaenrosea)根的分离物天冬酰胺中,分离到天冬氨酸。1868年Ritthausen从蛋白质中分离到天冬氨酸。由于最早在天冬草(asparagus)中发现,故而称为天冬氨酸。
1810年,英国科学家W. Wollaston从膀胱结石中发现胱氨酸,英文为 cystinol。而半胱氨酸,英文为Cysteine,因为它为胱氨酸的一半,所以中文名为半胱氨酸。
1819年,亮氨酸(又称白氨酸)是 Proust首先从奶酪中分离出来的,之后 1820年Braconnot从肌肉与羊毛的酸水解物中得到其结晶,并定名为亮氨酸。英文名称为Leucine,源于希腊语 leuco,意思是‘白的’。称其为白氨酸是因为它本身为白色粉末,称其为亮氨酸是因为它本身易于结晶,而且折光度很高,非常闪亮。
1820年,H. Braconnot 研究明胶水解时,分离出了甘氨酸,当时被认为是一种糖,后来发现这个“明胶糖”中含有氮原子,是最简单的氨基酸,称之为glycine(源于希腊语,’glykys’,意思是“甜的”)。事实上,甘氨酸的甜度是蔗糖甜度的80%。甘氨酸是人类发现的第一个氨基酸,也是最简单的、非极性的、不具有旋光性的氨基酸。
1856年,Von Group Besanez从胰脏的浸提液中分离出来缬氨酸,直至1906年由Fisher分析出其化学结构为2-氨基-3-甲基丁酸,并将其命名为缬氨酸valine,名称源于valerian(缬草)。同年, Cramer将丝胶蛋白(Sericine)置于硫酸中水解而得到丝氨酸,英文为 Serine,由于这种氮基酸是从丝胶(Sericine)蛋白中分离得到的,因此命名为“丝氨酸”。
1861年,德国的一位教授从小麦的面筋中第一次提取出味精的组成成分谷氨酸。1908年日本的池田菊苗又从海带煮出的汁当中分解出味精,作为人工调料第一次投放市场。由于过去主要从谷蛋白(glutelin)中提取而得,故称为谷氨酸。
1886 年,Schlus 从植物羽扇豆苗中分离提取到精氨酸。1895 年 Hedin 发现精氨酸存在于哺乳动物的蛋白质中。由于其天然品大量存在于鱼精蛋白(protamine)中,故被称为精氨酸。
1889年,Dreehsel从干酪素水解物分离出来赖氨酸当时,实际上得到的是赖氨酸与精氨酸的混合物,命名为 Lytatine。后来,Fisher从这个Lytatine将赖氨酸分离出来,并命名为赖氨酸,英文为Lysine。
1896年,德国医师 Albrecht Kossel首次从组蛋白中分离出组氨酸。
1901年,Fischer在白明胶中首先发现脯氨酸。英文学名为Pyrrolidone Carboxylic Acid(吡咯烷酮羧酸),简化为“Proline”。而中文名称“脯氨酸”则是因为它是胶原蛋白的重要构成成分,其中“脯”就有肉干、果干之意。同年,英国人Frederick Hopkins 和Syndey Cole 在1901年用胰岛素消化酪蛋白时分离得到色氨酸,英文为 Tryptophane,来源于Insulin (胰岛素)和phane,希腊语意思是‘出现’。
1935年,Mccoy等于从纤维蛋白切割产物中分离和鉴定出苏氨酸,英文为 Threonine,因结构与苏糖(threose)相似,故将其命名为苏氨酸。
在这之后陆续有其他氨基酸被单独发现,1900年左右通过化学家在实验室水解不同的蛋白,得到了很多种不同的氨基酸,就是有一个氨基一个羧基和一个侧链的结构的物质,并确定了氨基酸的命名规则。
2022年6月6日,日本宇宙航空研究开发机构的小行星探测器“隼鸟2号”(Hayabusa 2)从小行星“龙宫”带回地球的沙子样本中,发现了“生命之源”——氨基酸。这是首次在地球以外确认氨基酸的存在。2023年8月1日,西班牙科学家使用Yebes望远镜和IRAM射电望远镜首次在银河系中心附近的一团气体内,发现了氨基酸的重要成分碳酸,这可能有助于揭示地球上的生命是如何形成的4。
工业发展史
谷氨酸是世界上第一个工业化生产的氨基酸单一产品。1908年,日本味之素公司创始人池田菊苗(Kikunae Ikeda)在实验室中偶然发现:在海带浸泡液中可提取出一种白色针状结晶物,该物质具有强烈鲜味,结果分析表明它是谷氨酸的一种钠盐。池田菊苗最后找到了一种工业化生产味之素的新途径,即利用小麦粉加工淀粉后剩下的“面筋”为原料,首先用盐酸将其水解得到谷氨酸,然后加入纯碱中和,即可得到食品级的谷氨酸钠。这是世界上最早从事氨基酸工业化生产的实例。
20世纪60年代发展起来的工业微生物发酵法(Microbial fermentation)使氨基酸工业开始起飞,此后许多种常用氨基酸品种,如谷氨酸、赖氨酸、苏氨酸、苯丙氨酸等等均可利用微生物发酵法生产,从而使其产量大增,大大降低了生产成本大为下降5。
理化性质
物理性质
氨基酸固体通常为无色晶体,熔点超过200℃,比一般有机化合物的熔点高很多。氨基酸一般易溶于水、酸溶液和碱溶液中,不溶或微溶于乙醇或乙醚等有机溶剂(Organic Solvent)。不同种类氨基酸在水中的溶解度差别很大,酪氨酸的溶解度最小,25℃时,100g水中酪氨酸仅溶解0.045g。赖氨酸和精氨酸常以盐酸盐的形式存在,极易溶于水,因潮解而难以制得结晶。不同氨基酸有酸、甜、苦、鲜等不同味感。其中谷氨酸单钠和甘氨酸是用量最大的鲜味调味料6。
外观:各种常见的氨基酸多为无色结晶,结晶形状因氨基酸的结构不同而有所差异,如L–谷氨酸为四角柱形结晶,D–谷氨酸则为菱形片状结晶。
熔点:氨基酸结晶的熔点较高,一般在200~300℃,许多氨基酸在达到或接近熔点时会分解成胺和CO2。
溶解度:绝大部分氨基酸都能溶于水。不同氨基酸在水中的溶解度有差别,如赖氨酸、精氨酸、脯氨酸的溶解度较大,酪氨酸、半胱氨酸、组氨酸的溶解度很小。各种氨基酸都能溶于强碱和强酸中。但氨基酸不溶或微溶于乙醇。
味感:氨基酸及其衍生物具有一定的味感,如酸、甜、苦、咸等。其味感的种类与氨基酸的种类、立体结构有关。从立体结构上讲,一般来说,D–型氨基酸其甜味强度高于相应的L–型氨基酸。
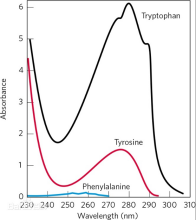
光吸收特性:20种常见氨基酸对可见光均无吸收能力。但其在远紫外区(小于220nm)有较小光吸收,在紫外区(220nm~300nm)只有酪氨酸、色氨酸和苯丙氨酸三种氨基酸有光吸收能力,是因为它们的R基含有苯环共轭双键系统。苯丙氨酸在259nm、酪氨酸在278nm、色氨酸在279nm有最大光吸收。因为蛋白质一般都含有这三种氨基酸,尤其是酪氨酸,因此可以利用280nm波长处的紫外吸收特性定量检测蛋白质的含量7。分光光度法测定蛋白质含量的依据是朗伯–比尔定律(Lambert Beer's law)。在280nm处蛋白质溶液吸光值与其浓度成正比8。
旋光性:除甘氨酸外,其他氨基酸有不对称C原子,可以用旋光仪测定其旋光性。左旋性氨基酸有丝氨酸(Ser)、亮氨酸(Leu)、脯氨酸(Pro)、色氨酸(Trp)、苯丙氨酸(Phe)等。右旋性氨基酸有丙氨酸(Ala)、异亮氨酸(Ile)、谷氨酸(Glu)、天冬氨酸(Asp)、缬氨酸(Val)、赖氨酸(Lys)、精氨酸(Arg)等15。
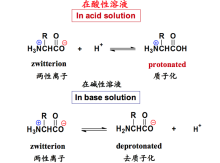
化学性质
氨基酸因为同时存在胺基和羧基,同时具有酸性和碱性,在酸性溶液中带正电荷,在碱性溶液中带负电荷,是典型的两性化合物。其中氨基可以发生酰化反应、亚硝酸反应、与醛反应、磺酰化反应、成盐反应等各种反应。羧基可以在一定条件下发生酰化、酯化、脱羧和成盐反应1。
等电点
因为氨基酸分子上带有能释放出质子的NH3+和能接受质子的COO-负离子,因此氨基酸是典型的两性电解质。氨基酸在水溶液或结晶内基本上均以兼性离子或偶极离子的形式存在。
氨基酸的等电点(Isoelectric Point):氨基酸的带电状况取决于所处环境的pH值,改变pH值可以使氨基酸带正电荷或负电荷,也可使它处于正负电荷数相等,即净电荷为零的两性离子状态。使氨基酸所带正负电荷数相等即净电荷为零时的溶液pH值称为该氨基酸的等电点,通常用pI表示。
当氨基酸溶液的pH大于pI时(如加入碱),氨基酸中的–NH3+给出质子,平衡右移,这时氨基酸主要以阴离子形式存在,若在电场中,则向正极移动。反之,当溶液的pH小于pI时(如加入酸),氨基酸中的–COO-结合质子,使平衡左移,这时氨基酸主要以阳离子形式存在,若在电场中,则向负极移动。
各种氨基酸由于其组成和结构的不同,而具有不同的等电点。中性氨基酸的等电点小于7,一般为5.0~6.5。酸性氨基酸的等电点为3左右。碱性氨基酸的等电为7.58~10.8。带电颗粒在电场的作用下,向着与其电性相反的电极移动,称为电泳(Electrophoresis)。由于各种氨基酸的相对分子质量和pI不同,在相同pH的缓冲溶液中,不同的氨基酸不仅带的电荷状况有差异,而且在电场中的泳动方向和速率也往往不同。因此,基于这种差异,可用电泳技术分离氨基酸的混合物。例如,天冬氨酸和精氨酸的混合物置于电泳支持介质(滤纸或凝胶)中央,调节溶液的pH至6.02(为缓冲溶液)时,此时天冬氨酸(pI=2.98)带负电荷,在电场中向正极移动,而精氨酸(pI=10.76)带正电荷,向负极移动9。
等电点的计算:首先写出解离方程,两性离子左右两端的表观解离常数的对数的算术平均值。一般pI值等于两个相近pK值之和的一半。
解离性
解离原则:羧基解离度大于氨基,α–C上基团大于非α–C上同一基团的解离度。即优先解离α–COOH,随后其他–COOH;然后解离α–NH3+,随后其他–NH2。
常见氨基酸的名称、缩写符号、R基及其基础物理性质
|| ||
酸碱滴定曲线
在酸碱滴定过程中,将体系pH随滴定过程进行程度 (一般是滴定剂的加入量或滴定分数 T )的变化规律绘制所得曲线为酸碱滴定曲线。以甘氨酸为例:1mol甘氨酸溶于水时,溶液pH为5.97,分别用标准NaOH和HCl滴定,以溶液pH值为纵坐标,加入HCl和NaOH的摩尔数为横坐标作图,得到滴定曲线。该曲线一个十分重要的特点就是在pH=2.34和pH=9.60处有两个拐点,分别为甘氨酸的pK1和pK2。
分类
氨基酸,顾名思义是指含有氨基的羧酸。生物体内的各种蛋白质是由20种基本氨基酸构成的。除甘氨酸外均为L–α–氨基酸(其中脯氨酸是一种L–α–亚氨基酸),R–α–
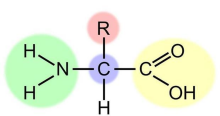
除甘氨酸外,其它蛋白质氨基酸的α–碳原子均为不对称碳原子,即与α–碳原子键合的四个取代基各不相同,因此氨基酸可以有立体异构体,即存在D–型与L–型两种构型8。




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国