深夜赶论文的你,是否感受过太阳穴突突跳动的神经性头痛?这种挥之不去的疼痛信号,其实与细胞膜上一类叫P2X4的"疼痛传感器"密切相关。复旦大学与中国药科大学联合团队近日在《Nature Communications》发表的突破性研究,就像给这个传感器装上了X光机,首次捕捉到镇痛药物如何通过"分子锁"机制让疼痛信号静音的全过程。
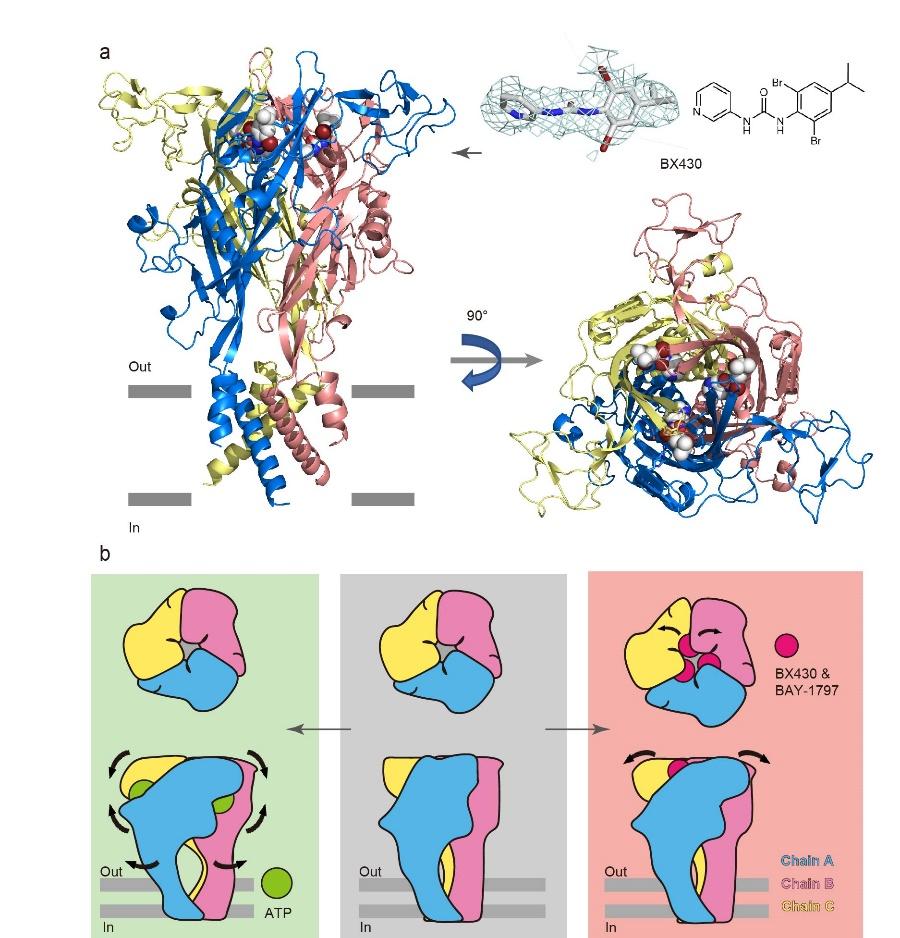
图1展示了科学家们用冷冻电镜技术拍摄的P2X4受体与抑制剂"亲密接触"的珍贵画面。
疼痛信号的守门人
在我们身体里,P2X受体家族就像细胞膜上的警报器,当ATP这种能量分子在组织受损时泄漏,就会触发它们打开离子通道,向神经系统发送疼痛信号。其中P2X4受体特别擅长放大慢性疼痛信号,是导致坐骨神经痛、糖尿病神经病变等顽固性疼痛的"元凶"。虽然科学家早知某些药物能关闭这个警报器,但具体操作密码始终成谜。
定格动画里的分子探戈
研究团队采用冷冻电镜技术,将处于工作状态的P2X4受体瞬间冷冻在-196℃的玻璃态冰中,捕捉到其与两种抑制剂BX430、BAY-1797共舞的百万分之一秒级动态。
生动展示了受体结构的关键变化:当药物分子进入受体侧面的"秘密口袋"时,原本向内弯曲的Lys氨基酸像弹簧插销般突然弹出,与邻近亚基的酪氨酸形成新的化学握手。这种巧妙的构象变化既腾出了药物结合空间,又像门闩般锁住了受体的活动部件。
分子锁的设计蓝图
通过对比不同状态的结构,科学家发现这些抑制剂不仅撑大了受体的结合口袋,更关键的是阻止了三个亚基的相对运动——就像给折叠椅的三个支腿装上固定卡扣。当研究团队用基因编辑技术改变关键氨基酸时,原本有效的药物突然"失灵",这验证了别构抑制的精准作用位点。更有趣的是,这种分子锁机制在其他P2X亚型中并不通用,为设计高特异性镇痛药提供了黄金靶点。
精准医疗的新曙光
这项研究不仅解开了困扰学界二十年的P2X4抑制之谜,更为新型镇痛药研发提供了"分子尺规"。未来基于这些结构数据,药物化学家可以像拼乐高一样设计更贴合结合口袋的分子,在避免传统镇痛药成瘾性的同时,精准关闭特定类型的疼痛信号。或许在不久的将来,困扰人类的慢性疼痛将迎来真正的"静音模式"。




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国