【译者之言:多数元素在自然界都有自己的同位素,但它们存在的数量一般都很小,尤其是最轻的元素氢,它的同位素氘只是微量存在。那科学家是如何找到它的呢?】
我打过交道的第一个诺贝尔奖得主,是美国化学家哈罗德·克莱顿·尤里(Harold Clayton Urey)(1893-1981)。但却是在一个不那么令人愉快的场合。
我在哥伦比亚大学读本科时主修化学,1939年6月获得学士学位。我打算继续我的研究生学业,而我也理所当然地认为我的申请会被接受。
然而,7月份我的申请被拒绝了,理由是我没有学习过物理化学课程,这是该领域研究生的必修课程。(不幸的是,我过于热心的父亲力推我学习医学,而医学院对物理化学课程并没有要求,所以我把时间花在了其他课程上。)
不过,我并没有放弃。9月份注册时,我去了哥伦比亚大学,坚持要与注册委员会面谈。委员会的负责人是化学系主任尤里。
他也很另类,一点都不喜欢阿西莫夫。而我的问题是嗓门太高、不善交际、没有礼貌、言辞尖刻,因此大多数教员都不看好我。(没有人怀疑我的智力,但不知怎么的,似乎并没有人把它当回事。)
我要求委员会允许我参加物理化学课程。这样,当我完成该课程后,就可以再次申请研究生身份了。这意味着我会损失一年,但除此之外我似乎也不知道该怎么办。然而,尤里不假思索,我一问完,他就说:“不行!”然后指了指房门。
我无意放弃,所以我找到了一份课程目录,其中一段规定说,如果满足了一定的要求(我都能满足),为了弥补缺失的课程,可以先成为“未分类研究生”。第二天,我挥舞着目录,又回到了尤里的办公室,重复了我的要求。尤里摇摇头,又指了指房门。我坚持自己的立场,要求知道他拒绝的原因。“基于什么理由?”我问道。
事实上,除了就是不喜欢我以外,他没有任何其它理由,但他又不想承认。他告诉我下午再回来。我照做了,然后他给了我一个建议。
他可以允许我学习物理化学课程,前提是我还得修满其他全部课程,而所有这些课程都以物理化学课程为基础。换句话说,在所有这些其他的课程中,教授们会认为学生们已经了解了物理化学,而除了我,所有其他学生确实都已学过了物理化学课程。
此外,我还会有一个考察期,如果平均成绩达不到B,就会因没有学分而辍学,而如果我去另一所大学,哥伦比亚大学不会给我出具任何文件,证明我已经通过的一些课程,我将被迫重修它们。这意味着我将损失一大笔学费;而在那些日子里,我真没有多余的钱可损失。
我现在已经很清楚了,尤里已经给了我建议,但他相信我不会接受,这样他就可以一劳永逸地摆脱我了。不过,他低估了我对自己能力的信心。我毫不犹豫地接受了这个建议。在那之后,我的平均成绩最终达到了B,解除了考察期,并成功地修完了我的研究生课程。
从那以后,我一直很难友好地想象尤里,尽管他在政治上和我站在一边。(1940年,当大多数教员都戴着威尔基的徽章时,尤里却在念叨着“罗斯福——劳动者的选择”。)不过,不管他喜欢我,还是不喜欢我,他都是一位一流的科学家,所以让我们来谈谈他的诺贝尔奖吧。
· · ·
故事开始于1913年,当时英国化学家弗雷德里克·索迪(Frederick Soddy)(1877-1956)首次提出了有力的论点,即一种特定元素的各种原子不一定完全相同,而是可以存在两个或两个以上的种类,他称之为“同位素”。
一开始,大家都认为,一种特定元素的同位素在化学性质上没有任何差异。然而,索迪的工作清楚地表明,它们在质量上会有所不同。
在索迪宣布这一消息的两年前,新西兰出生的物理学家欧内斯特·卢瑟福(Ernest Rutherford)(1871-1937)提出了带核原子的概念,而索迪曾和他一起工作,这一概念很快就被物理学家们所采纳。根据这个概念,原子包含了一个被大量电子包围的,微小的大质量原子核。
是电子的数量和排列支配着元素的化学性质,因此,很明显,一种特定元素的同位素必须具有相同的电子数和排列,否则它们的化学性质将会不相同。这意味着区分同位素的差异存在于原子核中。
1914年,卢瑟福提出了最简单的原子核(氢原子的原子核)由单个粒子组成的假设,他将单个粒子称为“质子”,而更复杂的核则由多个质子组成。单个质子的质量是电子的1836倍,但带有电荷的大小完全相等,虽然性质相反。质子的电荷是+1,电子是-1。
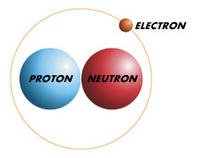
在一个电中性的普通原子中,原子核包含的质子数量必须正好等于原子核外部电子的数量,因此,原子核外部有92个电子的铀原子,其原子核内部就必须有92个质子。
然而,铀核的质量却是质子的238倍。为了解决这种异常现象,当时的物理学家(对他们来说,质子和电子是唯一已知的亚原子粒子)假设,除了质子之外,原子核还包含有质子/电子对。一个质子/电子对的质量大约是一个质子的质量(因为电子非常轻,它的质量几乎可以忽略不计)。此外,由于质子和电子的电荷相互抵消,因此质子/电子对所带电荷为零。
这样,一个铀核就可能由92个质子和146个质子/电子对组成。铀的总质量是单个质子的238倍,因此铀的“原子量”为238。由于铀核所带的正电荷等于92个质子的正电荷,因此铀的“原子序数”为92。
实际上,原子核内的质子/电子对的概念并没有被保留下来。这种质子/电子对由两个独立的粒子组成,而某些原子核特性却取决于原子核中粒子的总数。除非质子/电子对被单个粒子取代,否则这些原子核特性无法得到正常解释。单个粒子必须具有质子/电子对一样的性质,所以它必须拥有大约一个质子的质量,并且不带电。
这种粒子在20世纪20年代被广泛假设,但由于不带电荷,所以很难被探测到。直到1932年,英国物理学家詹姆斯·查德威克(James Chadwick)(1891-1974)才发现了它。他称之为“中子”,它几乎立马就取代了质子/电子对的位置。因此,铀原子的原子核可以被看作是由92个质子和146个中子组成的。
在20世纪20年代,物理学家使用质子/电子对来解释同位素的性质,但为了避免误导亲爱的读者,我将只提到中子,虽然对1932年之前发生的事件,使用中子的称呼是错误的。
所有铀原子的原子核都必须带有92个质子。与这个数字的任何偏差都意味着原子核外的电子数量一定不是92。这会改变原子的化学性质,它也就不再是铀了。不过,如果中子的数量改变了呢?这不会改变原子核的电荷或原子核外的电子数量,所以铀仍然是铀。但是,原子核的质量将会发生变化。
这样,1935年,加拿大裔美国物理学家阿瑟·杰弗里·登普斯特(Arthur Jeffrey Dempster)(1886-1950)发现了一种铀原子,其原子核中除了92个质子外,还有143个中子(不是146个)。其原子序数仍然是92,但是质量数为92+143=235。因此,我们有了铀-238和铀-235,这是自然界中存在的铀的两种同位素。可以肯定的是,它们存在的数量并不相同,同位素理论也并不认为它们的数量一定就相同。事实上,自然界中每1个铀-235原子对应着140个铀-238原子。
· · ·
通过对放射性原子及其分解方式的详细研究,索迪得出了他的同位素概念。不过,他的理论中也有一个弱点。放射性在1896年就已经被发现,起初似乎只涉及质量非常大的原子,这些原子自发地分解成较轻的原子。放射性原子似乎与普通原子非常不同,可能会出现争论说,同位素只存在于这些放射性元素中。
铀(原子序数92)和钍(原子序数90)是在自然界中广泛存在的两种放射性元素,它们的衰变最终以形成稳定元素铅(原子序数82)而结束。然而,铀分解成原子核由82个质子和124个中子组成的铅(铅-206),而钍分解成原子核由82个质子和126个中子组成的铅(铅-208)。
如果是这样的话,那么铅肯定至少由这两种同位素组成,并且在自然界中一定是以不同比例的这两种同位素的混合物存在的。从钍矿石中提取的铅一定富含铅-208,并且比从铀矿矿石中提取的铅的原子量更高。在1914年,索迪仔细地测定了不同来源的铅的原子量,结果表明,原子量上的差异确实很容易被检测到。
稳定元素铅由同位素组成这一事实本身,并不是对这一概念的重要扩展,因为铅的同位素是放射性元素分解的结果。我们所需要的是,证明同位素存在于与放射性毫无关联的元素中。
从不同来源获得的或用不同方法提纯的稳定元素(铅除外)的原子量没有显著差异。这可能是因为它们所有的原子都是一样的,或者是因为它们总是由相同的同位素混合物组成。
然而,如果我们可以分离同位素(假设它们是可以分离的),那又会怎么样呢?分离两种不同物质的常用方法是利用化学性质的差异。但是,某一特定元素的同位素在化学性质上本质上是相同的。
不过,一种特定元素的两种同位素质量是不同的。假设让这些同位素的原子核混合物在电磁场中加速。(在索迪那个时代,物理学家已经知道如何建立这样的场景。)带电荷的原子核会与磁场相互作用,并沿着一条弯曲的路径运动。原子核质量越大,其惯性就越大,因此弯曲程度也就越小。如果让运动中的原子核落在一张感光片上,显影后的照片会显示出两条曲线,因为每一种同位素都有其略微不同的路径。
1912年,英国物理学家约瑟夫·约翰·汤姆森(Joseph John Thomson)(1856-1940)在氖元素原子核的飞行轨迹中,注意到这样一种轻微分开的双路径。他不确定这意味着什么,但当第二年宣布同位素概念时,他检测到的似乎有可能是两种氖的同位素。
汤姆森的助手之一弗朗西斯·威廉·阿斯顿(Francis William Aston)(1877-1945)开始认真研究这个问题。他发明了一种装置,在这种装置中,电磁场能使某一特定质量的所有原子核都落在感光胶片上的一个点上。这个装置被称为“质谱仪”。从所产生的这些痕迹的位置,就可以计算出同位素的质量,而从痕迹的强度,则可以计算出相对数量。
1919年,阿斯顿用这种方法分离了氖原子核,从而证明该元素由两种同位素组成,氖-20和氖-22。更重要的是,在所有的氖原子中,大约每10个原子中有9个是氖-20,1个是氖-22。这就解释了为什么氖的相对原子质量是20.2。(后来,随着质谱仪的改进,又检测到了第三种同位素,氖-21。我们现在知道,在每1000个氖原子中,有909个是氖-20,88个是氖-22,,3个是氖-21。)
通过质谱仪的工作,阿斯顿发现许多稳定元素由两种或两种以上的同位素组成,这明确地确立了索迪的同位素概念。从那以后,就再也没有发生过什么让人质疑的事情了。
当一种元素的原子量与整数发生相当大的偏离时,我们就可以肯定它包含两种或两种以上的同位素,它们的原子量是质量和相对数量平均得来的。
许多元素的原子量几乎正好都是整数,那么很有可能该元素的所有原子都具有相同的质量。例如,氟、钠、铝、磷、钴、砷、碘、金仅由氟(19)、钠(23)、铝(27)、磷(31)、钴(59)、砷(75)、碘(127)、金(197)组成。

对于那些只有一种核的元素(总共有19种),我们很难称之为“isotope(同位素)”,因为这个术语意味着有两种或多种同一元素。出于这个原因,美国化学家杜鲁门·保罗·科曼(Truman Paul Kohman)(1916-)在1947年提出,每一个原子种类可以被称为“nuclide(核素)”。
这个词经常被使用,但我怀疑它是否能取代“isotope(同位素)”一词,因为“isotope”已经在语言中深深地扎根,无法被移除。此外,物理学家也学会了在实验室里制造自然界中不存在的同位素。这些人造同位素都是放射性的,所以它们被称为“放射性同位素”。任何只有一种稳定核素的元素肯定都可以制造出许多放射性同位素。如果考虑放射性同位素,那没有一种元素是只由一种核素组成的。因此,严格地说,“isotope(同位素)”一词是随时可以使用的。例如,我们只需说氟只有一种稳定的同位素,这意味着它还存在放射性同位素。
可以肯定的是,有些元素的原子量非常接近整数,而且是由一些稳定的同位素组成的。在这种情况下,该元素主要由这些同位素中的一种组成,其他的同位素非常稀少,因此,对原子量的贡献很小。
一个最早的例子是1929年的发现。美国化学家威廉·弗朗西斯·吉奥克(William Francis Giauque)(1895-1982)使用质谱仪显示氧由三种同位素组成,氧-16、氧-17和氧-18,它们都是稳定的。但氧-16是最常见的,每10000个氧原子中有9976个是氧-16,20个是氧18,4个是氧17。
这让化学家们发生了动摇,因为一百年来,他们一直武断地将氧的原子量设定为16.0000,并将其作为测量所有其他原子量的标准。1929年以后,这被称为“化学原子量”,而物理学家则使用氧-16=16.0000,作为“物理原子量”的标准。1961年,化学家和物理学家同意以碳-12=12.0000作为标准。这很接近化学原子量表。
如果你能确定,每个元素的同位素混合物,在任何时候和所有条件下都始终保持完全相同,那么氧=16.0000标准可能仍然是令人满意的。如果一个元素的不同同位素具有完全相同的化学性质,那么混合物将总是相同的,不过它们并不是。化学性质本质上是相同的,但还是有很小的差别。质量较大的同位素在参与任何物理或化学变化时,总是比质量较小的同位素变化要慢一些。因此,偶尔也有机会发现稍微不同的混合物。
1913年,美国化学家亚瑟·贝克特·拉姆(Arthur Becket Lamb)(1880-1952)制备了不同来源的水的各种样本,并将它们纯化到极致。可以肯定的是,每个样品中只包含了含有极少量杂质的水分子。然后,拉姆以当时能够达到的最大精确度,来确定了每个样品的密度。
如果所有的水分子完全相同,所有的密度在测量极限值内应该相同。然而,密度的变化是这些极限值的四倍。它与平均值偏离了不到百万分之一,但这是真实的,这意味着所有的水分子并不是完全相同的。第二年,一经引入了同位素的概念,我们就知道,这意味着氧或氢,或者两者,都是由同位素的混合物组成的。
水的分子是由两个氢原子和一个氧原子(H2O)组成的。如果所有的水分子都含有一个氧-18原子,那么这些水的密度将比普通的氧-16水高出近12%。可以肯定的是,拥有只含氧-18的水的机会几乎为零,但根据水的来源和纯化方法的不同,这种很小的变化则很容易解释拉姆的结果。
一个大质量同位素比一个小质量同位素动作更慢,这为两者的分离开辟了一条途径。早在1913年,阿斯顿就让氖气通过多孔隔板渗透。他的感觉是,质量较小的同位素(如果有的话)会通过得更快,所以在首先通过的样本中,质量较小的同位素比例会比正常情况要高,而剩下的同位素中,质量较大的同位素比例会比正常情况要高。他一遍又一遍地重复了这个过程,最终得到了一个氖气样本,这个样本中质量较大的同位素大量耗尽,其原子量为20.15,而不是正常的20.2。他还获得了原子量为20.28的氖气样本,因为样本中富含质量较大的同位素。
(这种方法和其他方法已经被用来增加元素样本中特定同位素的百分比。最精彩的例子是,核裂变炸弹的开发过程中,用于获得含有高于正常数量铀-235的铀浓缩工艺。)
· · ·
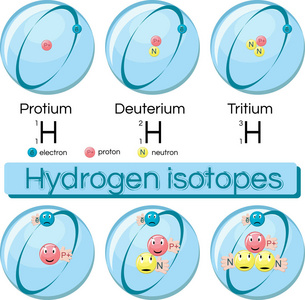
现在就出现了氢及其可能存在的同位素的问题。氢的原子量略小于1.008,这相当接近一个整数。这意味着氢可能只由一种同位素氢-1(原子核由一个质子组成,其它什么都没有)组成。如果它包含一个质量更大的同位素,它至少必须是氢-2(原子核由一个质子和一个中子组成),并且它只能是微量存在。
氢-2存在的数量非常小,除非采用富集了这种质量更大同位素的氢样本,否则不太容易被检测到。早在1919年,德国物理学家奥托·斯特恩(Otto Stern)(1888-1969)就试图使用阿斯顿的弥散方法来研究氢,但得到了否定的结果。他得出的结论是,氢只是由氢-1组成的。这是由于他的实验技术存在缺陷,但这在当时并不明显,他的报告阻碍了在这个方向上的深入研究。
质谱仪也没有给到任何帮助。确实有痕迹显示可能是氢-2存在的结果,但这些也可以是由两个氢-1原子组成的氢分子(H2)产生的结果。
1929年,氧的同位素被发现了,这样就让更准确地确定氢的原子量变得可能。现在,氢的原子量比起只由氢-1组成的原子量,似乎只高了一点点。1931年,两位美国物理学家雷蒙德·泰尔·伯格(Raymond Thayer Birge)和唐纳德·霍华德·门泽尔(Donald Howard Menzel)(1901-76)提出,如果每4500个氢原子中有一个氢-2原子,那就足以解释这种原子量高一点点的情况了。
显然,这激发了我未来的“仇敌”——尤里,进入战场。他首先试图在氢中发现氢-2的痕迹。
在他看来,从理论上考虑,氢-2和氢-1在加热时会以稍微不同的波长发出辐射。
这种光谱差异对所有的同位素都是存在的,但一般来说,这种差异都很难被发现。不过,同位素之间的差异并不是随着质量的差异而增加,而是随着质量的比率而增加。因此,铀-238质量比铀-235大3个单位,但前者质量只比后者大1.28%。
然而,随着总质量的减少,单位差的比值会迅速增加。因此,氧-18的质量比氧-16大12.5%,尽管差异只有2个单位。至于氢-2,它的质量应该比氢-1大100%,尽管只有1个单位的差异。
因此,两种氢同位素之间的光谱差异,应该远远大于任何其他元素的两个同位素之间的光谱差异,而尤里觉得检测两个氢同位素之间的光谱差异,比在质谱仪上检测质量差异更容易。
他计算了氢-2的谱线的波长,然后用非常大的光谱光栅研究了加热的氢的谱线。恰恰在他认为应该存在谱线的地方,他发现了模糊的线条。
如果为了追求发现氢-2的荣誉,尤里可以马上报告,但他是一位做事有条理和值得尊敬的科学家,他意识到所检测到的谱线非常微弱,有可能是氢气中的杂质或者是设备故障的结果。
这些谱线很微弱,因为氢中存在的氢-2很少。那么,他必须做的是,采取措施来增加氢-2的百分比,再看看光谱中所谓的H-2谱线是否会变得更清楚一些。
他没有尝试弥散法,这种方法已经让斯特恩失败了。相反,他想到,如果他将氢液化,让它慢慢蒸发,质量较小的氢-1原子会比氢-2原子更容易蒸发。因此,如果他从一升液氢开始,让99%的氢蒸发,剩下的最后一点氢中就可能含有比原来的氢中更丰富的氢-2。
他这样做了,而且也成功了。当他蒸发得到最后一点氢,将其加热,并研究其光谱时,他发现假设的氢-2谱线已经增强了6倍以上。根据他的初步计算,尤里确定每4500个氢-1原子对应1个氢-2原子,就像伯格和门泽尔所预测的那样。不过,后来的研究表明,这一点还超出了估计。实际上,每6500个氢-1原子才对应1个氢-2原子。
1931年12月底,在美国物理学会一次会议上的10分钟演讲中,尤里展示了他的研究结果。他的正式书面报告发表于1932年。
· · ·
事实证明,氢-2的发现是非常重要的。由于氢-1和氢-2的质量比有很大的差异,证明分离这两种同位素比分离任何其他两种同位素都要容易得多。很快,人们就获得了纯度相当高的氢-2(“重氢”)样品,以及含有氢-2(代替氢-1)分子的水(“重水”)的样品。
重氢和重水的处理使得氢的同位素似乎值得拥有一个特别的名字。尤里建议使用希腊语“deuterium(氘)”(意思是“第二”),因为如果将所有的同位素都按质量增加的顺序排列的话,最轻的氢-1,将是第一,而氢-2第二轻,则是第二。
显然,到1934年,化学家和物理学家研究氢-2的渴望,促进了科学的显著进步。(确实也是如此,我将在下一篇随笔中加以解释),而当1934年尤里获得诺贝尔化学奖时,真的一点也不奇怪。
更重要的是,尤里并没有坐享其荣誉,而是继续在生命起源、行星化学等方面从事重要的研究工作。他可能不喜欢我,我也可能不喜欢他,但他是一位伟大的科学家。
(作者:艾萨克.阿西莫夫(Isaac Asimov),译者:劲松,校对:晓燕)




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国