“‘安东尼’,这名字不错。”
可是,说这句话的老人已经忘了,安东尼就是他自己的名字。
在获得今年奥斯卡6项提名的电影《困在时间里的父亲》中,安东尼是一位84岁的退休工程师。但在他的世界里,一切都混乱得犹如一部悬疑片——早逝的小女儿又复活了,女儿和女婿突然变成了护工和医生,自己的公寓突然变成了养老院……
安东尼只是一位普通的老人,但他患上了阿尔茨海默病。
被困在记忆的迷宫里,这是大部分阿尔茨海默病患者的境地。当我们老了的时候,也会像安东尼这样,忘记自己的亲人,甚至连自己的名字都忘了吗?
答案是可怕的。目前我国75岁以上老年人中,阿尔茨海默病的发病率超过10%,85岁以上发病率超过30%。换句话说,当我们也步入85岁之后,每三个人中就有一个会面临这样的困局。
在疾病过程中,阿尔茨海默病患者的大脑经历了大量神经元的死亡,逐渐丧失正常的功能。同样,物理学家霍金患的肌萎缩侧索硬化(渐冻人症)、拳王阿里患的帕金森病等脑疾病,也是脑中不同类型的神经元出现死亡导致的。随着中国人口老龄化程度的加深,预计2050年将有超过2000万的阿尔茨海默病患者,其他脑疾病患病人数也会越来越多。探索和治疗这类脑疾病成为当前科学界最重要且急迫的任务之一,而这正需要脑科学的发展。
关于大脑,我们未知的还有太多
脑是人体中最复杂,也可能是最重要的器官。有了大脑,我们才能在这里讨论关于脑和人类自身的一切;目前临床判断死亡的标准,也从传统的心跳停止改为了全脑功能丧失。人脑中约有1000亿个神经元,这差不多是天文学家估计的银河系恒星的数量,是地球人口的10倍以上。这些神经元形成了错综复杂的连接,整合成一个巨大的网络,就像电影《阿凡达》中的潘多拉星球一样,动植物都联结在一起——从这个意义上,我们每个人的肩上都载着一个小星球般复杂的自我。研究如此复杂的对象,脑科学面对着重重困难。
100多年前,既是画家也是神经科学家的圣地亚哥·拉蒙-卡哈尔(Santiago Ramón y Cajal)通过高尔基银染法,让动物皮层中的神经元可以被普通光学显微镜观察到,记录下了这些神经元的形态和结构。
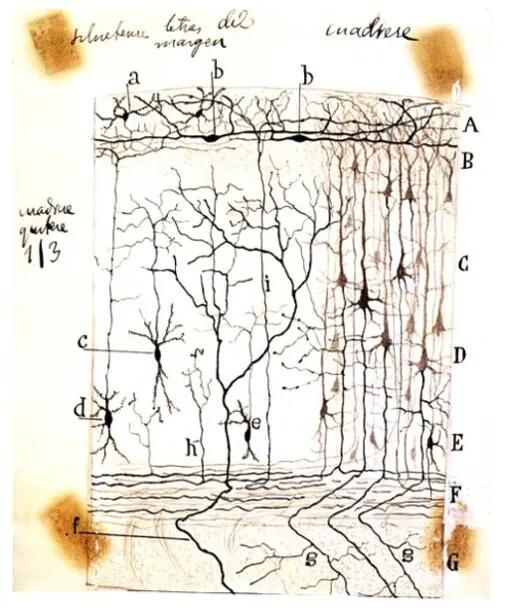 卡哈尔用高尔基银染法观察到的皮层神经元(1890-1891年)丨参考资料[1]
卡哈尔用高尔基银染法观察到的皮层神经元(1890-1891年)丨参考资料[1]
100多年后的今天,我们依然会惊叹于这位先驱细致的观察和记录,也会被神经元精妙复杂的结构震撼。经过一代代科学家的努力,我们目前已经大致知道了不同类型的神经元和它们编码、储存、传递的信息,也了解了不同脑区的功能。目前,已经有20余次诺贝尔奖颁发给了脑科学领域的研究。
但是,当前的脑科学研究缺乏好的理论框架来理解脑网络如何协同工作;在已经探索过的问题上,也依然有很多关键的细节尚不清楚。
比如,在阿尔茨海默病的研究中,科学家发现,患者的大脑皮层中广泛出现β淀粉样蛋白的斑块沉积,同时tau蛋白出现缺陷,导致神经纤维缠结在一起。进一步的研究还发现,阿尔茨海默病的大脑有更高的炎症反应水平,时常伴随着疱疹病毒的感染;阿尔茨海默病模型小鼠的脑中,一些神经元会表现出超过正常水平的兴奋,血管对大脑氧气和营养的供给也会出现障碍。最新的研究中甚至指出,一些致密的β淀粉样蛋白的斑块是脑的一种自我保护机制。然而,目前为止我们并不知道,观察到的这些现象哪个是因、哪个是果,或者更加让人头痛的是——它们可能互为因果。
2005年,国际权威学术期刊《科学》公布了125个全世界最前沿、最具挑战的科学问题,其中有近20个问题与脑科学相关,如“人类的意识存在于何处”、“大脑如何建立道德观念,产生合作行为”、“记忆如何存储和提取”、“为什么我们需要睡眠并且会做梦”、“成瘾的机制是什么”、“孤独症、精神分裂症的病因是什么”、“如何延续阿尔茨海默病患者的生命”等等。
16年后,《科学》在今年4月又公布了新版的125个科学问题,之前脑科学相关的很多科学问题仍出现在这个新版本中。这并不是说脑科学在16年间停滞不前,而是随着科学家的新发现,未知的问题也变得更多了。
我们为什么需要脑科学研究?
脑科学的基础研究艰辛复杂,但脑科学又是如此重要,在满足人类对自身的好奇、推动人工智能发展之外,最重要也最直接的意义便是维护人类的脑健康。
根据世卫组织统计,全球脑疾病带来的社会经济负担已经超过心血管疾病和癌症,位列第一。有学者估算,脑疾病在中国造成的年均社会负担为6972亿元。
从1~2岁就会发病的孤独症,到青年高发的抑郁症,再到中老年更可能出现的脑卒中、阿尔茨海默病、帕金森病等,各种脑疾病的影响覆盖了我们的一生。脑科学的研究,可以从多个角度帮助我们对抗这些疾病。
首先,脑科学可以帮助我们更早、更精确做出疾病诊断。比如,传统的自闭症临床诊断主要依靠行为量表,很大程度上会受到医生的主观影响。经过数十年的研究,科学家们已经确认了数百个孤独症相关的基因,基因检测的辅助可以提高对孤独症诊断的精准程度,并且根据不同的突变基因提出针对性的治疗和干预方案。同时,对孤独症儿童的神经影像学研究也总结出区分正常儿童和患儿的规律,进一步提高了诊断的成功率。
其次,在发现了疾病相关的基因之后,科学家们会尝试在实验动物如小鼠、猴子上建立疾病模型,以此更深入地研究疾病的机制;这些研究的成果能为药物研发奠定基础。清华大学姚俊研究组就鉴定出了Syt7基因,这是一种和双相情感障碍高度相关的基因;在敲除Syt7的小鼠上又进一步发现,GluN2B-NMDAR蛋白是产生抑郁或者躁狂的关键。针对这种蛋白进行药物开发,可能是较好的途径。
美国各大药厂和国立卫生研究院(NIH)已经投入了上千亿美元,用以研发治疗阿尔茨海默病的药物,但绝大多数都失败了。目前美国FDA仅批准了5款治疗阿尔茨海默病的药物上市,这些药物的功效也只是减速疾病的恶化。究其原因,很可能是因为我们对阿尔茨海默病的理解还不够深入。
但探究的脚步仍未停止,一些新技术、新方法已经在实验动物上进行尝试,给我们带来新的治疗希望。例如,加州大学付向东研究组发现,在大脑黑质的星形胶质细胞上敲低PTB蛋白,可以将其转化为多巴胺神经元,这能有效恢复帕金森病模型小鼠大脑中多巴胺的浓度,治疗帕金森病导致的运动障碍。中科院陈跃军研究组则尝试在体外将干细胞诱导为多巴胺神经元,再注射回帕金森病模型小鼠脑中,也达到了类似的效果。这样的基因治疗和干细胞治疗方法,目前也在人类上进行临床实验。
最后,脑科学有时会给我们带来审视疾病的全新视角。近年来很多研究表明,脑肠轴(即脑和肠道的双向连接)以及肠道菌群,可能参与了许多脑疾病的发病,如抑郁症、精神分裂症、阿尔茨海默病等。这些看起来只是脑子出了问题的疾病,都被发现和脑肠轴紊乱存在密切的联系。清华大学钟毅、祁海和上科大胡霁研究组,则在小鼠中发现了一条从大脑杏仁核和室旁核到脾脏的神经通路,不同的情绪和状态会通过这条通路增强或者抑制免疫反应。适度的运动之所以可以增强免疫力,或许就是激活了大脑杏仁核,从而增强了抗体的产生。
从基础研究到最终的临床诊断、治疗有漫长的路要走。但正是因为有了这些研究,我们才可能知道走哪条路是有希望的、怎么走才不容易在途中迷路。
探索浩瀚脑海,他们在行动
人类对于脑科学很早就已有构想。1999年上映的《黑客帝国》,可以说是脑科学为人熟知的一角;而最近流行的游戏《赛博朋克 2077》中,脑机接口技术的应用场景则更为丰富,甚至有点天马行空,换个角度去看,更像是在造超能力者。那么从虚构的电影回到现实生活,人类脑科学的发展又是怎样一番情景呢?
近十年来,美国、欧盟、日本等西方经济体纷纷推出了“脑计划”,在脑科学领域投入大量资金。在多年的筹划后,中国的脑计划也于“十三五”期间正式启动。毫无疑问,脑科学将是21世纪最前沿、最重要的科学领域之一。
不过不同于电影中的酷炫,现实中的脑科学基础研究颇为艰辛,不仅费时费力、各种研发成本高昂,且成功率极低,短时间内难有商业回报,这不仅需要政府公共财政的支持,更需要大量社会资金的投入。
你或许还记得,几个月之前,马斯克创建的Neuralink公司在直播中,把一枚硬币大小的设备植入猪脑,创建了猪脑和计算机的数字链接,而背后的Neuralink公司已经完成了接近2亿元的融资;同样,Facebook也以约10亿美元高价收购脑机接口创企CTRL-Labs。在国内,IDG资本则是投入脑科学研究走在前端的代表性企业。
十年前的2011年,在清华大学百年校庆之际,IDG创始人麦戈文先生与清华大学签署协议,成立了清华大学-IDG/麦戈文脑研究所。同年十一月,又成立了北京大学和北京师范大学麦戈文脑科学研究院。十年后的今天,再次适逢清华大学110周年校庆,“IDG资本-清华脑科学发展基金捐赠仪式”在清华大学隆重举行,双方合作的再次延续。
截至目前,麦戈文先生及IDG资本已累计向清华、北大、北师大IDG/麦戈文脑研究院捐赠了2亿人民币,未来还将继续捐赠,预计每年不少于2000万人民币,并计划不断增加。
IDG资本作为中国最早的风险投资机构,不仅将基础科研作为重点支持的方向,同时也在投资中重注前沿科技。IDG资本在新能源、芯片半导体、企业服务、区块链等多个领域都是国内最早进行投资布局的投资机构。1994年开始投资芯片半导体,2007年开始投资光伏太阳能,2012年开始系统性布局企业服务2B领域,2012年开始投资区块链,现在看来,这些布局都早于真正风口到来8至15年。同时在医疗健康赛道,IDG资本进行了全产业链布局,涵盖生物医药、精准诊断和人工智能医疗等多个领域。
正是因为前方有太多未知,我们需要更多像IDG资本这样的企业共同行动,在科学研究和产业转化之间搭建更加高效的沟通桥梁,让科技真正为人类所用。
在IDG的支持下,各高校脑科学研究已然硕果累累。眼前的脑科学研究成果当然值得我们骄傲,而这些全都基于人类那颗经过亿万年的进化、地球其他生物无可匹敌的大脑。这个被阿兰·图灵称为“一碗凉粥”的器官,存在于我们的两耳之间的那个坚固的容器中。你能在手机上打开这篇文章并且成功读到这里,就有它的功劳。
我们看似已经将大脑运用得炉火纯青,但是却又不得不承认,它还有太多等着我们去挖掘、了解——从大脑如何产生智力、进行运算,到前面提到的阿尔茨海默病等脑疾病的治疗。以至于科学家们在不断研究大脑的过程中,也得出了“若是我们的大脑简单到可以被我们理解,我们将愚蠢到无法理解自己的大脑”这样看似荒谬但又无比贴近实际的悖论。
一想到我们或许会通过自己打造的科学手段,真正探究清楚自己的“最强大脑”,你是不是也已经开始对未来无比期待了呢?
参考文献
[1] Ramón y Cajal, S. (1923). Recuerdos de mi vida. Madrid: Imprenta de Juan Pueyo.
Gil, V., Nocentini, S., & Del Río, J. A. (2014). Historical first descriptions of Cajal–Retzius cells: from pioneer studies to current knowledge. Frontiers in neuroanatomy, 8, 32.
[2] Huang, Y., Happonen, K. E., Burrola, P. G., O’Connor, C., Hah, N., Huang, L., ... & Lemke, G. (2021). Microglia use TAM receptors to detect and engulf amyloid β plaques. Nature Immunology, 1-9.
[3] Hur, J. Y., Frost, G. R., Wu, X., Crump, C., Pan, S. J., Wong, E., ... & Li, Y. M. (2020). The innate immunity protein IFITM3 modulates γ-secretase in Alzheimer’s disease. Nature, 586(7831), 735-740.
[4] Itzhaki, R. F. (2018). Corroboration of a major role for herpes simplex virus type 1 in Alzheimer’s disease. Frontiers in aging neuroscience, 10, 324.
[5] Jameson, K. G., Olson, C. A., Kazmi, S. A., & Hsiao, E. Y. (2020). Toward understanding microbiome-neuronal signaling. Molecular cell.
[6] Miles, J. H. (2011). Autism spectrum disorders—a genetics review. Genetics in Medicine, 13(4), 278-294.
[7] Qian, H., Kang, X., Hu, J., Zhang, D., Liang, Z., Meng, F., ... & Fu, X. D. (2020). Reversing a model of Parkinson’s disease with in situ converted nigral neurons. Nature, 582(7813), 550-556.
[8] Wang, Q. W., Lu, S. Y., Liu, Y. N., Chen, Y., Wei, H., Shen, W., ... & Yao, J. (2020). Synaptotagmin-7 deficiency induces mania-like behavioral abnormalities through attenuating GluN2B activity. Proceedings of the National Academy of Sciences, 117(49), 31438-31447.
[9] Waye, M. M., & Cheng, H. Y. (2018). Genetics and epigenetics of autism: A Review. Psychiatry and clinical neurosciences, 72(4), 228-244.
[10] Xiong, M., Tao, Y., Gao, Q., Feng, B., Yan, W., Zhou, Y., ... & Zhang, S. C. (2021). Human stem cell-derived neurons repair circuits and restore neural function. Cell Stem Cell, 28(1), 112-126.
[11] Zhang, X., Lei, B., Yuan, Y., Zhang, L., Hu, L., Jin, S., ... & Qi, H. (2020). Brain control of humoral immune responses amenable to behavioural modulation. Nature, 581(7807), 204-208.
[12] Zott, B., Simon, M. M., Hong, W., Unger, F., Chen-Engerer, H. J., Frosch, M. P., ... & Konnerth, A. (2019). A vicious cycle of β amyloid–dependent neuronal hyperactivation. Science, 365(6453), 559-565.
[13] http://www.gov.cn/xinwen/2019-07/15/content_5409694.htm
[14] https://www.who.int/data/gho/data/themes/mortality-and-global-health-estimates
[15] http://www.chinanews.com/sh/2017/08-01/8292512.shtml





 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国